Tutorial Menjawab Soal tentang Menentukan Persamaan dan Konstanta Laju Reaksi
Seperti yang dijelaskan sebelumnya bahwa persamaan laju reaksi tidak dapat ditentukan langsung dari persamaan reaksi melainkan harus melaui suatu percobaan / eksperiment. Salah satu cara menentukan persamaan laju reaksi berdasarkan data eksperimen adalah dengan menggunakan metode laju awal. Menurut cara ini laju diukur pada awal reaksi dengan konsentrasi yang berbeda beda.
Untuk tingka SMA kita hanya akan mempelajari cara menentukan persamaan laju reaksi dengan mengolah data percobaan sederhana. Ini juga sudah lumayan sulit. . .hheh…semangat ya mempelajarinya….Oke mari kita mulai!!
Perhatikanlah data berikut:
Dari hasil percobaan diperoleh data sebagai berikut !
Reaksi yang terjadi adalah : A + B → C + D
Tentukanlah :
A. Orde reaksi terhadap A
B. Orde reaksi terhadap B
C. Persamaan laju reaksi
D. Orde reaksi
E. Harga konsntanta laju reaksi
F. Besar laju reaksi jika konsentrasi A dan B yang digunakan masing masing adalah 2 x 10-2 M
Wah soalnya banyak kali ye. . . . .tapi jangan ciut dulu nyali nya. . . kalau kalian coba perhatikan dan pahami pasi kalian bisa. . . . . oke mari kita menjawabnya . . . .
Orde reaksi terhadap A
Langkah pertama buatlah dahulu persamaan umum laju reaksinya dengan memisalkan x sebagai orde reaksi terhadap A dan y sebagai orde reaksi terhadap B. kalian bisa gunakan huruf apa saja yang kalian suka. . . . disini kita boleh bebas berekspresi . . . haha. . .
Dari reaksi :
A + B → C + D
Persamaan umum laju reaksi = k [A]x [B]y
(dalam menentukan persamaan laju reaksi yang kita butuhkan hanyalah konsentrasi perekasi saja, untuk konsentrasi produk dan koefisien reaksi kita abaikan saja dulu)
Untuk mencari harga x yaitu orde reaksi terhadap A, cari lah duat adata pada soal yang konsentrasi B nya sama, kemduian kedua data itu kita bandingkan.
Dari tabel dapat kita lihat bahwa percobaan 1, 2 dan 3 memiliki harga [B] yang sama. Silahkan pilih dua saja mana yang kalian suka, ingat pilihan menentukan mudah atau sulitnya perhitungan . . . jadi pilihlah dengan bijak. . . hahha..kalau saya akan pilih percobaan 2 dan 3.
Karena harga k dan konsentrasi B pada kedua percobaan sama maka bisa kita coret saja. Hasilnya adalah :
Harga orde reaksi terhadap A adalah 1
Harga orde reaksi terhadap B
Kebalkan cara yang pertama, untuk mencari nilai y yaitu orde reaksi terhadap B, cari dua data percobaa pada soal yang [A] nya sama yaitu percobaan 2, 4 dan 5. Saya pakai percobaan 4 dan 5, karena 2 udah pada soal A.
Harga orde reaksi terhadap B juga 1.
Persamaan laju reaksi
Dari persamaan umum laju reaksi : v = k [A]x [B]y
Dengan harga x = 1 dan y = 1, maka persamaan laju reaksi untuk rekasi diatas adalah :
v = k [A]1 [B]1 atau v = k [A] [B] (pangkat satu tidak udah ditulis)
Orde reaksi = x + y = 1 + 1 = 2
Reaksi diatas memiliki orde reaksi tingkat 2.
Konstanta laju reaksi (k)
Untuk menentukan harga k, kalian bisa gunakan persamaan laju reaksi yang sudah kita temukan ke salah satu percobaan pada tabel karena seyogyanya akan menghasilkan nilai k yang sama.
Percobaan 1
[A] = 2 x 10-3
[B] = 2 x 10-3
v = 5 x 10-5
Masukkan data diatas ke persamaan laju reaksi :
Jika kita coba mencari harga k dengan percobaan 3
[A] = 8 x 10-3
[B] = 2 x 10-3
v = 2 x 10-4
Masukkan data diatas ke persamaan laju reaksi :
Ternyata hasilnya juga sama. Harga konstanta laju reaksi (k) untuk rekasi diatas adalah 12,5 M-1s-1
Jika kita gunakan [A] dan [B] sama yaitu = 2 x 10-2 , maka harga laju reaksinya akan menjadi :
v = k [A] [B] = (12,5) (2 x 10-2 ) (2 x 10-2 ) = 5 x 10-3
Nah ternyata mudah kan menjawab soalnya . . . walaupun panjang juga jalannnya . . . .
Selain data laju reaksi yang disajikan / diukur dalam percobaan, bisanya juga digunakan data waktu reaksi berlansung.
Apa hubungan waktu (t) dengan laju reaksi (v)???
Bayangkan saja, jarak kota A dan kota B adalah 100 Km, jika seseorang melaju dari kota A ke kota B dengan kecepatan yang lambat, maka akan dibutuhkan waktu lebih lama sampai dibandingkan seseorang yang melaju dengan kecepatan yang lebih cepat. Hal ini juga berlaku pada kecepatan / laju reaksi. Jika reaksi berlangsung cepat maka waktu yang dibutuhkan hingga reaksi selesai akan sedikit dibandngkan jika reaksi berlangsung lambat.
v = 1/t ata t = 1 /v ( laju reaksi berbanding terbalik dengan waktu )
Contoh soal :
Perhatikan data pada tabel berikut untuk reaksi : A + B → C + D
Tentukanlah persamaan laju reaksinya?
Pembahasan :
Reaksi : A + B → C + D
Persamaan umum laju reaksi : v = k [A]x [B]y
Harga x → orde reaksi terhadap A → cari [B] yang sama
Karena yang diketahu bukan harga laju reaksi (v) tetapi t, maka kita pakai hubungan v = 1/t
Harga y → orde reaksi terhadap B → cari [A] yang sama
Persamaan laju reaksinya : v = k [A]x [B]y = k [A]1 [B]0 = k [A]
Oke mudah kan. . . .
Ada masalah lahi nih guys. . . . bagaimana kalau data percobaannya, ada konsentrasi yang tidak sama?? Bagaimana cara menyelesaikannya. Untuk mengathui jawabannya marilah kita perhatikan contoh berikut ini :
Contoh Soal :
Dalam suatu percobaan penentuan laju reaksi P + Q → hasil, diperoleh data sebagai berikut :
Dari percobaan diatas dapat disimpulkan bahwa orde reaksi totalnya adalah . . . .
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan :
Pada soal diatas , [P] tidak memiliki data yang sama di percobaan 1 – 5, dan untungnya [Q] ada data yang sama. Jadi biar semangat, kita mulai dulu mencari nilai orde reaksi untuk P ya dengan menggunakan data [Q] yang sama . . . .
Reaksi : P + Q → hasil
Persamaan umum laju reaksi = v = k [P]x [Q]y
Harga x → pakai percobaan 1 dan 3 saja
Lalu bagaimana cara mencari harga y, yaitu orde reaksi terhadap Q, karena [P] nya tidak ada yang sama??? Jangan bingung. . . pilih saja dua data pada percobaan tersebut walaupun tidak ada yang sama. Pilihlah dengan hati hati, agar memudahkan kita dalam proses perhitungan . . . saya pilih data 3 dan 4 . . .
Wah ternyata dengan cara begitu kita bisa juga menyelesaikannya. Ye ye ye. . . .
Maka persamaan laju reaksi = v = k [P] [Q]2
Orde reaksi = x + y = 1 + 2 = 3
Masalah terselesaikan . . . ..
Eiits. .. jangan senang dulu, bagaimana kalau kedua perekasi datanya tidak ada yang sama???
Wah untuk menjawab permasalahan terakhir ini saya akan bagiakan dipotingan selanjutnya ya guys . . . soalnya capek ngetiknya. . . hahahah. . . . sekian postingan kali ini tentang cara menjawab soal untuk menentukan persamaan dan harga konstanta laju reaksi . . . semoga bermanfaat . . . .jangan lupa dishare ya. . . terimakasih. . . .












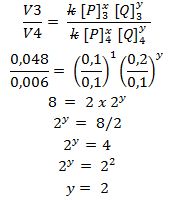
Posting Komentar untuk "Tutorial Menjawab Soal tentang Menentukan Persamaan dan Konstanta Laju Reaksi"