Tutorial Menjawab Soal Bab Kesetimbangan Kimia Part 1
Hay, udah mau ulangan ya???. Biar dapet nilai tinggi yuk mari kita belajar. Ini kelanjutan dari postingan tentang bab kesetimbangan kimi. Kalau sebelumnya saya udah upload tutorial tentang menjawab soal persubbab dalam bab ini, nah postingan kali ini khusus membahas tentang persiapan kalian buat dapetin nilai ulangan bab kesetimbangan yang memuaskan. Ada dua part seri tutorial soal ini, Part 2 lanjut disini ya.
Oke mari kita mulai.
Soal 1
Tetukanlah rumus Kc dari reaksi reaksi kesetimbangan berikut!
A. CaO(s) + H2O(l) Ca(OH)2(aq)
Ca(OH)2(aq)
B. HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)
NaCl(aq) + H2O(l)
Pembahasan:
Soal pertama kita mulai dari yangmudah dulu, biar otak dipanasin dulu ya. Pada soal ini diberikan reaksi dan kita disuruh untuk membuat rumus Kc dari masing masing reaksi.
Ingat!!
Apa itu Kc??? Kc adalah rumus konstanta kesetimbangan dimana dinyatakan dengan hasil bagi konsentrasi reaktan dengan konsentrasi produk dipangkatkan masing masing koefisiennya. Karena yang dibutuhkan adalah data konsentrasi, maka zat yang akan kita masukkan dalam rumus Kc adalah zat dengan fase (g) dan (aq) saja. Karena untuk zat dengan fase (s) dan (l) konsentrasinya tidak akan pernah berubah. Ingat ini, penting sekali.
Reaksi A
CaO(s) + H2O(l) Ca(OH)2(aq)
Ca(OH)2(aq)
CaO dan H2O tidak akan kita masukkan ke dalam rumus Kc, sehingga Kc untuk reaksi diatas adalah Kc = [Ca(OH)2]
Reaksi B
HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)
NaCl(aq) + H2O(l)
H2O tidak kita masukkan dalam rumus Kc reaksi diatas karena fesenya (l), jadi rumus Kc untuk reaksi tersebut adalah :
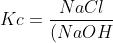(HCl)})
Nah mudah kan!! Oke kita masuk ke zona selanjutnya.
Soal 2
Tentukanlah rumus tetapan kesetimbangan parsial dari reaksi rekasi berikut!
A. 2SO2(g) + O2(g) 2SO3(g)
2SO3(g)
B. NH4Cl(s) NH3(g) + HCl(g)
NH3(g) + HCl(g)
Pembahasan:
Nah apa lagi itu Kp, masih ada lagi rumus tetapan kesetimbangan??
Ya, masih ada lagi, tapi tenang mudah kok menentukannya. Konsepnya masih sama yaitu hasil bagi produk dengan reaktan dipangkatkan koefisiennya, tapi kali ini yang dibagi adalah tekanan parsial gas masing masing spesi dalam reaksi.
Pahami!!
Bagaimana cara menentukan tekanan parsial???. Tekanan parsial suatu zat dalam reaksi adalah hasil bagi mol zat dibagi dengan mol total, kemudian dikali dengan tetakan total sistem. Nah tentu ada syarat zat dalam fase apa yang kita gunakan untuk perhitungan ini. Karena berhubungan dengan tekanan, hanya zat dalam fase (g) yang mempunyai tekanan jadi zat dengan fase itulah yang kita gunakan dalam perhitungan Kp.
Soal diatas kita hanya disuruh membuat rumus Kpnya saja. Untuk perhitungannya silahkan menuju tutorial Part 2 ya.
Reaksi A : 2SO2(g) + O2(g) 2SO3(g)
2SO3(g)
Semuanya gas, jadi semua kita pakai dalam rumus Kp.
^{2}}{P(SO2)^{2}(O2)})
Reaksi B : NH4Cl(s) NH3(g) + HCl(g)
NH3(g) + HCl(g)
NH4Cl kan (s) jadi tidak kita pakai dalam menentukan rumus Kp.
.P(HCl))
Nah gampang kan, pasti bisa lah ya kalian.
Oke mari kita tinggkatkan stadium soal.
Soal 3
Diketahui pada kesetimbangan berikut :
2CO2(g) + 2H2(g) 2CO(g) + 2H2O(s)
2CO(g) + 2H2O(s)  = + x kkal
= + x kkal
Tentukan arah pergeseran kesetimbangan jika:
A. Suhu dinaikkan
B. Volume sistem diperbesar
C. Konsentrasi gas CO2 dikurangi
D. Gas CO yang terbentuk dipindahkan.
Pembahasan :
Ini adalah soal mengenai faktor faktor yang mempengaruhi pergeseran kesetimbangan. Ada 4 faktor yang mempengaruhi pergeseran kesetimbangan yaitu suhu, volume/tekanan dan konsentrasi. Untuk memahasinya marilah langsung kita jawab soal diatas, cekidot.
A. Suhu dinaikkan
Tolong dibaca dan dipahami, kemudian yan dihafalkan. Kan nanti kalu ujian ngak boleh lihat contekan. hehe
Untuk suhu, kalian harus tahu jenis reaksinya apakah eksoterm atau endoterm. Kalian dapat melihatnya dari data perubahan entalpi ( ) nya yang jika bertanda +, berarti endoterm dan sebalikknya jika bertanda - maka tergolong eksoterm.
) nya yang jika bertanda +, berarti endoterm dan sebalikknya jika bertanda - maka tergolong eksoterm.
Jika suhu dinaikkan maka kesetimbangan akan bergeser kearah reaksi endoterm, sedangkan jika suhu diturunkan maka kesetimbangan akan bergeser kearah reaksi eksoterm.
Dari panah reaksi akan ada dua (panah bolak balik), kalian juga harus bisa menentukan arah mana yang eksoterm dan endoterm.
Jika :
 ,
,  = + maka reaksi ke kanan (produk) endoterm dan kekiri (reaktan) eksoterm
= + maka reaksi ke kanan (produk) endoterm dan kekiri (reaktan) eksoterm
 ,
,  = -, maka reaksi kekanan (produk) eksoterm dan kekiri (reaktan) endoterm
= -, maka reaksi kekanan (produk) eksoterm dan kekiri (reaktan) endoterm
Reaksi pada soal diatas termasuk endoterm karena harga nya + kearah produk dan seksotermm ke arah reaktan. Nah jika suhunya dinaikkan maka kesetimbangan akan bergeser kearah produk yaitu pembentukan gas CO dan air jadi lebih banyak.
nya + kearah produk dan seksotermm ke arah reaktan. Nah jika suhunya dinaikkan maka kesetimbangan akan bergeser kearah produk yaitu pembentukan gas CO dan air jadi lebih banyak.
B. Volume diperbesar.
Volume berbanding terbalik dengan tekanan gas. Jika volume besar, maka tekanan pasti kecil, bgitu juga sebalikknya jika volume kecil maka tekanan besar. Jika dilakukan :
Tekanan diperbesar = Volume diperkecil = Kesetimbangan bergeser kearah koefisien terkecil.
Tekanan diperkecil = Volume diperbesar = Kesetimbangan bergerser kearah koefisien terbesar.
Pada reaksi diatas, jumlah koefisien kiri = 4 dan koefisien kanan = 2 (karena yang (s) kan ngak dihitung dan jika volumenya diperbesar maka kesetimbangan akan bergeser kearah oefisien terbesar yaitu kerah reakstan.
C. Konsentrasi gas CO dikurangi.
Jika konsentrasi reaktan diambil, maka supaya setimbang kembali, reaksi kesetimbangan akan berbeser kearah pembentukan reaktan yang diambil tapi sampai setimbang kembali. Hal ini juga akan berlaku sebaliknya jika konsentrasi reaktan ditambah, maka supaya setimbang, produknya yang produksinya harus ditambah sampai setimbang.
Jadi intinya begini :
Jika konsentrasi spesi dalam reaksi setimbang ditambah = kesetimbangan bergeser ke lawannya
Jika konsentrasi spesi dalam reaksi setimbang dikurangi = kesetimbangan begeser ke dirinya sendiri.
Pada reaksi soal diatas kan konsentrasi CO dikurangi maka tentu kesetimbangan bergeser ke arahnya sendiri yaitu kearah produk
D. Gas CO yang terbentuk dipindahkan.
Artinya kan gas COnya dikurangi jumlahnya. Jawabannya sama dengan poin C. Silahkan buat sendiri kesimpulannya. Oke.
Soal 4
Pembuatan amonia melalui proses Haber - Bosch berlangsung dengan persamaan kesetimbangan sebagai berikut :
N2(g) + 3H2(g) 2NH3(g)
2NH3(g)  = - 22 kJ
= - 22 kJ
Perlakuan apa saja yang akan membuat produksi NH3 optimal?
Pembahasan :
Soal ini kita disuruh untuk membuat tindakan akar produksi NH3 maksimal. Ini juga langkah yang dilakukan pabrik pembuatan amonia agar produksinya meningkat tentunya makin untung (wah kimia bisa gitu ya, Hebaaaaat), Untuk penjelasannya sudah ada disoal sebelumnya.
1. Suhu diturunkan
Alasannya : Karena reaksi pembentukan NH3 adalah eksoterm, agar kesetimbangan bergerser kearahnya maka suhu harus diturunkan.
2. Volume diperkecil = tekanan diperbesar
Alasannya : karena jumlah koefisien produk (NH3) lebih kecil dibandingkan reakstan, maka dengan memperbesar tekanan/memperkecil volume maka kesetimbangan akan begeser ke koefisien terkecil.
3. Konsentrasi reasktan ditambah, sehingga kesetimbangan bergeser ke arah pembentukan NH3 makin banyak. Tapi sepertinya bukan langkah yang bagus dalam industri karena bahan baku yang dibutuhkan jadi lebih banyak. Perusahaan kan ngak mau rugi, he he eh
Soal 5
Sebanyak 1 mol gas NH3 dalam ruang 2 L terurai menurut persamaan reaksi :
2NH3(g) N2(g) + 3H2(g)
N2(g) + 3H2(g)
Jika saat setimbang terdapat gas H2 sebanyak 0,6 mol. Tentukan harga Kc?
Pembahasan ;
Wah, ini soal sudah masuk perhitungan ya. Ayo fokuskan pikiran untuk melahap soal satu ini.
Yang perlu kalian ingat!! Soalnya penting dan banyak orang yang salah gara gara ini.
1. Yang kita butuhkan untuk menghitung Kc adalah M, bukan mol, jadi ubahlah ke M dulu. Jika volume ruangnya 1 L, mungkin tidak apa apa, karena M = n/V, sehingga jika V = 1 L, maka hasil M nya akan sama dengan mol. Tapi biar tidak mudah lupa, carilah selau M nya walaupun V = 1 L
2. Jika pada bab laju reaksi, untuk menghitung konstanta laju reaksi yang kita gunakan adalah zat yang bereaksi, tetapi pada bab kesetimbangan yang kita gunakan adalah zat yag bersisa/setimbang.
Agar tidak bingung perhatikanlah cara berikut!
Pertana, kita buat dulu stoikiometri rekasinya,
2NH3(g) N2(g) + 3H2(g)
N2(g) + 3H2(g)
mula mula 1 mol - -
reaksi
sisa/stb 0,6 mol
Jika pada saat setimbang terdapat 0,6 mol H2, maka pada saat reaksi juga terjadi pembentukan 0,6 mol H2.
2NH3(g) N2(g) + 3H2(g)
N2(g) + 3H2(g)
mula mula 1 mol - -
reaksi 0,6 mol
sisa/stb 0,6 mol
Mol N2 yang bereaksi = 1/3 x 0,6 mol = 0,2 mol. Jika terbentuk 0,2 mol pada saat reaksi maka pada kedaan setimbangpun hasilnya juga begitu.
Mol NH3 yang bereaksi = 2/3 x 0,6 mol = 0,4 mol
Mol NH3 yang bersisa/pada saat setimbang = 1 - 0,4 mol = 0,6 mol
Setelah itu baru cari konsentrasi masing masing zat pada keadaan setimbang dengan membagi molnya dengan V
M NH3 = 0,6 mol/2L = 0,3 M
M N2 = 0,2 mol/2L = 0,1 M
M H2 = 0,6 mol/2L = 0,3 M
Maka harga Kc adalah :
![Kc = \frac{[N2][H2]^{3}}{[NH3]^{2}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;Kc&space;=&space;\frac{[N2][H2]^{3}}{[NH3]^{2}})
Kc = (0,1)(0,09)/(0,09
= 0,1
Saya tulis ini pada malam hari, rencanay mau lanjutin langsung part 2, tapi udah ngantuk. Sekian dulu part 1 nya ya , semoga bermanfaat dan kalian semakin suka dengan kimia. Terimakasih telah berkunjung.
Lanjut Part 2
Oke mari kita mulai.
Soal 1
Tetukanlah rumus Kc dari reaksi reaksi kesetimbangan berikut!
A. CaO(s) + H2O(l)
B. HCl(aq) + NaOH(aq)
Pembahasan:
Soal pertama kita mulai dari yangmudah dulu, biar otak dipanasin dulu ya. Pada soal ini diberikan reaksi dan kita disuruh untuk membuat rumus Kc dari masing masing reaksi.
Ingat!!
Apa itu Kc??? Kc adalah rumus konstanta kesetimbangan dimana dinyatakan dengan hasil bagi konsentrasi reaktan dengan konsentrasi produk dipangkatkan masing masing koefisiennya. Karena yang dibutuhkan adalah data konsentrasi, maka zat yang akan kita masukkan dalam rumus Kc adalah zat dengan fase (g) dan (aq) saja. Karena untuk zat dengan fase (s) dan (l) konsentrasinya tidak akan pernah berubah. Ingat ini, penting sekali.
Reaksi A
CaO(s) + H2O(l)
CaO dan H2O tidak akan kita masukkan ke dalam rumus Kc, sehingga Kc untuk reaksi diatas adalah Kc = [Ca(OH)2]
Reaksi B
HCl(aq) + NaOH(aq)
H2O tidak kita masukkan dalam rumus Kc reaksi diatas karena fesenya (l), jadi rumus Kc untuk reaksi tersebut adalah :
Nah mudah kan!! Oke kita masuk ke zona selanjutnya.
Soal 2
Tentukanlah rumus tetapan kesetimbangan parsial dari reaksi rekasi berikut!
A. 2SO2(g) + O2(g)
B. NH4Cl(s)
Pembahasan:
Nah apa lagi itu Kp, masih ada lagi rumus tetapan kesetimbangan??
Ya, masih ada lagi, tapi tenang mudah kok menentukannya. Konsepnya masih sama yaitu hasil bagi produk dengan reaktan dipangkatkan koefisiennya, tapi kali ini yang dibagi adalah tekanan parsial gas masing masing spesi dalam reaksi.
Pahami!!
Bagaimana cara menentukan tekanan parsial???. Tekanan parsial suatu zat dalam reaksi adalah hasil bagi mol zat dibagi dengan mol total, kemudian dikali dengan tetakan total sistem. Nah tentu ada syarat zat dalam fase apa yang kita gunakan untuk perhitungan ini. Karena berhubungan dengan tekanan, hanya zat dalam fase (g) yang mempunyai tekanan jadi zat dengan fase itulah yang kita gunakan dalam perhitungan Kp.
Soal diatas kita hanya disuruh membuat rumus Kpnya saja. Untuk perhitungannya silahkan menuju tutorial Part 2 ya.
Reaksi A : 2SO2(g) + O2(g)
Semuanya gas, jadi semua kita pakai dalam rumus Kp.
Reaksi B : NH4Cl(s)
NH4Cl kan (s) jadi tidak kita pakai dalam menentukan rumus Kp.
Nah gampang kan, pasti bisa lah ya kalian.
Oke mari kita tinggkatkan stadium soal.
Soal 3
Diketahui pada kesetimbangan berikut :
2CO2(g) + 2H2(g)
Tentukan arah pergeseran kesetimbangan jika:
A. Suhu dinaikkan
B. Volume sistem diperbesar
C. Konsentrasi gas CO2 dikurangi
D. Gas CO yang terbentuk dipindahkan.
Pembahasan :
Ini adalah soal mengenai faktor faktor yang mempengaruhi pergeseran kesetimbangan. Ada 4 faktor yang mempengaruhi pergeseran kesetimbangan yaitu suhu, volume/tekanan dan konsentrasi. Untuk memahasinya marilah langsung kita jawab soal diatas, cekidot.
A. Suhu dinaikkan
Tolong dibaca dan dipahami, kemudian yan dihafalkan. Kan nanti kalu ujian ngak boleh lihat contekan. hehe
Untuk suhu, kalian harus tahu jenis reaksinya apakah eksoterm atau endoterm. Kalian dapat melihatnya dari data perubahan entalpi (
Jika suhu dinaikkan maka kesetimbangan akan bergeser kearah reaksi endoterm, sedangkan jika suhu diturunkan maka kesetimbangan akan bergeser kearah reaksi eksoterm.
Dari panah reaksi akan ada dua (panah bolak balik), kalian juga harus bisa menentukan arah mana yang eksoterm dan endoterm.
Jika :
Reaksi pada soal diatas termasuk endoterm karena harga
B. Volume diperbesar.
Volume berbanding terbalik dengan tekanan gas. Jika volume besar, maka tekanan pasti kecil, bgitu juga sebalikknya jika volume kecil maka tekanan besar. Jika dilakukan :
Tekanan diperbesar = Volume diperkecil = Kesetimbangan bergeser kearah koefisien terkecil.
Tekanan diperkecil = Volume diperbesar = Kesetimbangan bergerser kearah koefisien terbesar.
Pada reaksi diatas, jumlah koefisien kiri = 4 dan koefisien kanan = 2 (karena yang (s) kan ngak dihitung dan jika volumenya diperbesar maka kesetimbangan akan bergeser kearah oefisien terbesar yaitu kerah reakstan.
C. Konsentrasi gas CO dikurangi.
Jika konsentrasi reaktan diambil, maka supaya setimbang kembali, reaksi kesetimbangan akan berbeser kearah pembentukan reaktan yang diambil tapi sampai setimbang kembali. Hal ini juga akan berlaku sebaliknya jika konsentrasi reaktan ditambah, maka supaya setimbang, produknya yang produksinya harus ditambah sampai setimbang.
Jadi intinya begini :
Jika konsentrasi spesi dalam reaksi setimbang ditambah = kesetimbangan bergeser ke lawannya
Jika konsentrasi spesi dalam reaksi setimbang dikurangi = kesetimbangan begeser ke dirinya sendiri.
Pada reaksi soal diatas kan konsentrasi CO dikurangi maka tentu kesetimbangan bergeser ke arahnya sendiri yaitu kearah produk
D. Gas CO yang terbentuk dipindahkan.
Artinya kan gas COnya dikurangi jumlahnya. Jawabannya sama dengan poin C. Silahkan buat sendiri kesimpulannya. Oke.
Soal 4
Pembuatan amonia melalui proses Haber - Bosch berlangsung dengan persamaan kesetimbangan sebagai berikut :
N2(g) + 3H2(g)
Perlakuan apa saja yang akan membuat produksi NH3 optimal?
Pembahasan :
Soal ini kita disuruh untuk membuat tindakan akar produksi NH3 maksimal. Ini juga langkah yang dilakukan pabrik pembuatan amonia agar produksinya meningkat tentunya makin untung (wah kimia bisa gitu ya, Hebaaaaat), Untuk penjelasannya sudah ada disoal sebelumnya.
1. Suhu diturunkan
Alasannya : Karena reaksi pembentukan NH3 adalah eksoterm, agar kesetimbangan bergerser kearahnya maka suhu harus diturunkan.
2. Volume diperkecil = tekanan diperbesar
Alasannya : karena jumlah koefisien produk (NH3) lebih kecil dibandingkan reakstan, maka dengan memperbesar tekanan/memperkecil volume maka kesetimbangan akan begeser ke koefisien terkecil.
3. Konsentrasi reasktan ditambah, sehingga kesetimbangan bergeser ke arah pembentukan NH3 makin banyak. Tapi sepertinya bukan langkah yang bagus dalam industri karena bahan baku yang dibutuhkan jadi lebih banyak. Perusahaan kan ngak mau rugi, he he eh
Soal 5
Sebanyak 1 mol gas NH3 dalam ruang 2 L terurai menurut persamaan reaksi :
2NH3(g)
Jika saat setimbang terdapat gas H2 sebanyak 0,6 mol. Tentukan harga Kc?
Pembahasan ;
Wah, ini soal sudah masuk perhitungan ya. Ayo fokuskan pikiran untuk melahap soal satu ini.
Yang perlu kalian ingat!! Soalnya penting dan banyak orang yang salah gara gara ini.
1. Yang kita butuhkan untuk menghitung Kc adalah M, bukan mol, jadi ubahlah ke M dulu. Jika volume ruangnya 1 L, mungkin tidak apa apa, karena M = n/V, sehingga jika V = 1 L, maka hasil M nya akan sama dengan mol. Tapi biar tidak mudah lupa, carilah selau M nya walaupun V = 1 L
2. Jika pada bab laju reaksi, untuk menghitung konstanta laju reaksi yang kita gunakan adalah zat yang bereaksi, tetapi pada bab kesetimbangan yang kita gunakan adalah zat yag bersisa/setimbang.
Agar tidak bingung perhatikanlah cara berikut!
Pertana, kita buat dulu stoikiometri rekasinya,
2NH3(g)
mula mula 1 mol - -
reaksi
sisa/stb 0,6 mol
Jika pada saat setimbang terdapat 0,6 mol H2, maka pada saat reaksi juga terjadi pembentukan 0,6 mol H2.
2NH3(g)
mula mula 1 mol - -
reaksi 0,6 mol
sisa/stb 0,6 mol
Mol N2 yang bereaksi = 1/3 x 0,6 mol = 0,2 mol. Jika terbentuk 0,2 mol pada saat reaksi maka pada kedaan setimbangpun hasilnya juga begitu.
Mol NH3 yang bereaksi = 2/3 x 0,6 mol = 0,4 mol
Mol NH3 yang bersisa/pada saat setimbang = 1 - 0,4 mol = 0,6 mol
Setelah itu baru cari konsentrasi masing masing zat pada keadaan setimbang dengan membagi molnya dengan V
M NH3 = 0,6 mol/2L = 0,3 M
M N2 = 0,2 mol/2L = 0,1 M
M H2 = 0,6 mol/2L = 0,3 M
Maka harga Kc adalah :
Kc = (0,1)(0,09)/(0,09
= 0,1
Saya tulis ini pada malam hari, rencanay mau lanjutin langsung part 2, tapi udah ngantuk. Sekian dulu part 1 nya ya , semoga bermanfaat dan kalian semakin suka dengan kimia. Terimakasih telah berkunjung.
Lanjut Part 2

Posting Komentar untuk "Tutorial Menjawab Soal Bab Kesetimbangan Kimia Part 1"