pOH dan pKw
pOH
Jika pH bergantung pada konsentrasi H+, maka pOH nilainya bergantung pada konsentrasi OH- dalam larutan. Secara matematika dirumuskan sebagai berikut :
pOH = - log [OH-]
Contoh.
Jika suatu larutan mengandung konsentrasi ion OH- dalam larutan adalah 0,001 M.
Maka pOH = - log [OH-]
= - log 0,001
= - log 1 x 10^-3
= 3
Sebalikknya jika diketahui pOH sama dengan 2 misalnya, maka konsentrasi OH- dalam larutan tersebut adalah:
= 10^-pOH
= 10^-2 = 1 x 10^-2
Nah intinya rumus pOH dan pH adalah sama. Hanya tinggal mengganti konsentrasi H+ untuk mencari pH dan OH- untuk mencari pOH.
Jika larutannya asam, maka nilai pH < 7 sedangkan jika larutannya basa maka pH > 7. Untukcontoh diatas kan larutan yang dicari adalah basa tapi pOH nya 2. Nanti di bagian akhir akan dijelaskan hubungn pH dan pOH sehingga konsep pH asam dan basa akan lebih jelas.
Tetapan Kesetimbangan Air (Kw)
Tahukah kalian sebenarnya air dalam gelas yang sering kita minum itu berada dalam reaksi kesetimbangan?
Sebagai buktinya adalah air dapat menghantarkan arrus listrik walaupun sangat buruk. Salah satu penyebabnya adalah bahwa air mengalami ionisasi menjadi ion H+ dan OH-. Reaksi ionisasi air ini berada dalam kesetimbangan dengan laju reaksi pengionan sama dengan pembentukan air. Sehingga seolah olah kita tidak melihat bahwa air itu mengion.
Reaksi ionisasi air.
H2O(l) <==> H+(aq) + OH-(aq)
Berdasarkan reaksi tersebut tentu kita bisa membuat konstanta kesetimbangannya sebagai berikut :
![K = \frac{[H^{+}][OH^{-}]}{[H_{2}O]}](https://latex.codecogs.com/gif.latex?K&space;=&space;\frac{[H^{+}][OH^{-}]}{[H_{2}O]})
Karena H2O dalam reksi diatas berwujid l (liquid), maka konsentrasinya akan selalu tetap sehingga dianggap konstan dan tidak mempengaruhi konsntanta kesetimbangan. Konstanta kesetimbangannya menjadi:
![K_{w} = [H^{+}][OH^{-}]](https://latex.codecogs.com/gif.latex?K_{w}&space;=&space;[H^{+}][OH^{-}])
Hasil kali konsentrasi H+ dan OH- inilah yang disebut dengan konstanta kesetimbangan air, disimbolkan dengan Kw.
Hubungan H+dengan OH-
Pada suhu kamar (25 derajat Celsius) konsntanta kesetimbangan air Kw =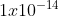 .
.
Dalam air murni, pH air selalu 7. Artinya kosentrasi H+ dan OH- dalam larutan adalah selalu sama.
[H+] = [OH-] = x
[H+][OH-] = Kw
(x) (x) =Kw
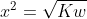
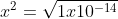
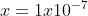
Artinya konsentrasi H+ dan OH- dalam larutan netral = 1 x 10^-7 M.
Jika dalam air ditambahkan zat asam, maka jumlah ion H+ akan semakin banyak sehingga larutan akan bersifat asam. Tetapi harga konstanta kesetimbangan atau hasil kali ion H+ dan OH- akan selalu tetap karena kesetimbangan akan bergeser kekiri. Pergeseran kesetimbangan ini akan membuat konsentrasi ion OH- berkurang. Begitu juga sebaliknya jika ditambah basa.
Artinya:
Kw = [H+][OH-]
Jika larutan netral: [H+] = [OH-]
Jika larutan asam :[H+] > [OH-]
Jika larutan basa : [H+] < [OH-]
Contoh:
Berapa konsentrasi ion H+ dalam larutan yang konsentrasi ion OH- nya = 0,025
Jawab :
[H+][OH-] = Kw
[H+] = Kw/[OH-]
= 1 x 10^-14/2,5 x 10^-2
= 4 x 10^-13 M
Hubungan pH dengan pOH
Kw = [H+][OH-] , Kemudian logaritmaka kedua ruas
- log Kw = - log ([H+][OH-] )
- log Kw = - log [H+] + [- log OH-]
pKw = pH + pOH
pH ditambah pOH adalah pKw. Pada suhu kamar kan diketahui Kw = 1 x 10^-14, maka:
pH + pOH = pKw
= - log Kw
= -log (1 x 10^-14)
= 14
Jadi harga pH maksimum pada suhu kamar adalah 14.
Jika Asam =pH <7
Jika Basa = pH > 7
Kemabli pada soal pertama tadi. Jika diketahui pOHnya = 3, maka pH = 14 - pOH = 14-3 = 11. Karenya pHnya 11 larutan akan bersifat basa.
Sampai disini saya rasa kalian sudah mengerti Konsep pH, pOH dan pKw.
Jika pH bergantung pada konsentrasi H+, maka pOH nilainya bergantung pada konsentrasi OH- dalam larutan. Secara matematika dirumuskan sebagai berikut :
pOH = - log [OH-]
Contoh.
Jika suatu larutan mengandung konsentrasi ion OH- dalam larutan adalah 0,001 M.
Maka pOH = - log [OH-]
= - log 0,001
= - log 1 x 10^-3
= 3
Sebalikknya jika diketahui pOH sama dengan 2 misalnya, maka konsentrasi OH- dalam larutan tersebut adalah:
= 10^-pOH
= 10^-2 = 1 x 10^-2
Nah intinya rumus pOH dan pH adalah sama. Hanya tinggal mengganti konsentrasi H+ untuk mencari pH dan OH- untuk mencari pOH.
Jika larutannya asam, maka nilai pH < 7 sedangkan jika larutannya basa maka pH > 7. Untukcontoh diatas kan larutan yang dicari adalah basa tapi pOH nya 2. Nanti di bagian akhir akan dijelaskan hubungn pH dan pOH sehingga konsep pH asam dan basa akan lebih jelas.
Tetapan Kesetimbangan Air (Kw)
Tahukah kalian sebenarnya air dalam gelas yang sering kita minum itu berada dalam reaksi kesetimbangan?
Sebagai buktinya adalah air dapat menghantarkan arrus listrik walaupun sangat buruk. Salah satu penyebabnya adalah bahwa air mengalami ionisasi menjadi ion H+ dan OH-. Reaksi ionisasi air ini berada dalam kesetimbangan dengan laju reaksi pengionan sama dengan pembentukan air. Sehingga seolah olah kita tidak melihat bahwa air itu mengion.
Reaksi ionisasi air.
H2O(l) <==> H+(aq) + OH-(aq)
Berdasarkan reaksi tersebut tentu kita bisa membuat konstanta kesetimbangannya sebagai berikut :
Karena H2O dalam reksi diatas berwujid l (liquid), maka konsentrasinya akan selalu tetap sehingga dianggap konstan dan tidak mempengaruhi konsntanta kesetimbangan. Konstanta kesetimbangannya menjadi:
Hasil kali konsentrasi H+ dan OH- inilah yang disebut dengan konstanta kesetimbangan air, disimbolkan dengan Kw.
Hubungan H+dengan OH-
Pada suhu kamar (25 derajat Celsius) konsntanta kesetimbangan air Kw =
Dalam air murni, pH air selalu 7. Artinya kosentrasi H+ dan OH- dalam larutan adalah selalu sama.
[H+] = [OH-] = x
[H+][OH-] = Kw
(x) (x) =Kw
Artinya konsentrasi H+ dan OH- dalam larutan netral = 1 x 10^-7 M.
Jika dalam air ditambahkan zat asam, maka jumlah ion H+ akan semakin banyak sehingga larutan akan bersifat asam. Tetapi harga konstanta kesetimbangan atau hasil kali ion H+ dan OH- akan selalu tetap karena kesetimbangan akan bergeser kekiri. Pergeseran kesetimbangan ini akan membuat konsentrasi ion OH- berkurang. Begitu juga sebaliknya jika ditambah basa.
Artinya:
Kw = [H+][OH-]
Jika larutan netral: [H+] = [OH-]
Jika larutan asam :[H+] > [OH-]
Jika larutan basa : [H+] < [OH-]
Contoh:
Berapa konsentrasi ion H+ dalam larutan yang konsentrasi ion OH- nya = 0,025
Jawab :
[H+][OH-] = Kw
[H+] = Kw/[OH-]
= 1 x 10^-14/2,5 x 10^-2
= 4 x 10^-13 M
Hubungan pH dengan pOH
Kw = [H+][OH-] , Kemudian logaritmaka kedua ruas
- log Kw = - log ([H+][OH-] )
- log Kw = - log [H+] + [- log OH-]
pKw = pH + pOH
pH ditambah pOH adalah pKw. Pada suhu kamar kan diketahui Kw = 1 x 10^-14, maka:
pH + pOH = pKw
= - log Kw
= -log (1 x 10^-14)
= 14
Jadi harga pH maksimum pada suhu kamar adalah 14.
Jika Asam =pH <7
Jika Basa = pH > 7
Kemabli pada soal pertama tadi. Jika diketahui pOHnya = 3, maka pH = 14 - pOH = 14-3 = 11. Karenya pHnya 11 larutan akan bersifat basa.
Sampai disini saya rasa kalian sudah mengerti Konsep pH, pOH dan pKw.
Artikel ini termasuk dalam seri artikel Bab Larutan Asam dan Basa. Kamu dapat mengunjungi artikel lain tentang bab ini melalui daftar link berikut:
- Teori Asam Basa Arrhenius
- Teori Asam Basa Bronted-Lowry
- Teori Asam Basa Lewis
- Asam Basa Kuat
- Asam Basa Lemah
- Derajat Ionisasi dan Hubungannya dengan Ka dan Kb
- Menghitung pH Larutan Asam
- Menghitung pH Larutan Basa
- Cara Kerja Indikator Kertas Lakmus Dalam Membedakan Senyawa Asam dan Basa
- Reaksi Penetralan
- Reaksi - Reaksi Asam Basa
- Asam - Asam Paling Berbahaya Di Dunia
- Perbedaan Asam dan Basa Kuat Dengan Asam Dan Basa Lemah
- Daftar Lengkap Senyawa Asam Kuat, Basa Kuat, Asam Lemah, Basa Lemah Beserta Reaksi Ionisasinya
- Menghitung pH Campuran Dua Larutan Asam Atau Dua Larutan Basa
- Menentukan pH Campuran Larutan Asam Kuat dan Basa Kuat
- Menentukan Warna Indikator Dalam Larutan Dengan pH Tertentu
- Menentukan Massa Zat Yang Harus Dilarutkan Untuk Membentuk Larutan Asam atau Basa Dengan pH Tertentu
- Urutan Kekuatan Asam dan Basa Berdasarkan pH dan Ka atau Kb
Posting Komentar untuk "pOH dan pKw"