Soal Essay Menghitung pH Asam dan Basa Kuat + Pembahasan
Soal obejktif yang ada optionnya mungkin jika tidak tahu kita bisa menebak asal saja dan berpeluang jawabannya benar sekit 20%. Nah bagaimana dengan soal soal yang berbentuk Essay???? Tentu kalian wajib memahami materi yang akan diujiannkan. Nah sambil memahi materi agar dapat menjawab soal soal berbentuk Essay, kali ini kita akan bahas bersama sol essay kimia tentang pH larutan asam dan basa kuat. Cekidot . . . .
Soal 1
Tentukanlah konsentrasi ion H+ dan OH- dari larutan 0,2 M_{2}) !
!
Pembahasan :
Nah soal ini sangat mudah sekali, jadi pasti kalian dapat dengan mudah mencarinya.
_{2}) adalah basa kuat dengan valensi 2, sehingga yang harus kita cari terlebih dahulu adalah berapa konsentrasi ion OH- nya.
adalah basa kuat dengan valensi 2, sehingga yang harus kita cari terlebih dahulu adalah berapa konsentrasi ion OH- nya.
[OH-] = Valensi basa x M basa kuat
= 2 x 0,2 M
= 0,4 M = M
M
Nah untuk mencari berapa konsentrasi ion H+ dalam larutan tersebut, kita gunakan hubungan pH, pOH dan pKw. Nilai Kw kalian wajib hafal yaitu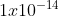
[H+] x [OH-] = Kw
[H+] x =
=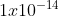
[H+] =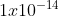 /
/ 
= M
M
Nah sangat mudah bukan . . .Ayo kita lanjut soal berikutnya.
Soal 2
Mengapa penambahan ion H+ dalam air menyebabkan air bersifat asam?
Pembahasan :
Mungkin kita pernah memasukkan air jeruk dalam air, maka rasa air akan jadi asam sama seperti rasa jeruk tersebut. Kenapa demikian?? Jawaban sederhananya adalah karena pada air jeruk terdapat ion H+ yang akan menambah jumlah ion H+ dari air sehingga jumlahnya lebih banyak daripada ion OH-. Hal ini menyebabkan larutan bersifat asam.
Untuk membuktikannya marilah kalian perhatikan contoh beriut :
Air ==> pH = 7 ==> artinya [H+] = [OH-]
Pada saat pH sama dengan 7, maka kosentrasi ion H+ akan sama dengan ion OH- yaitu sebgai berikut :
[H+] x [OH-] = Kw
[H+] x [H+] = Kw (karena [OH-] sama dengan [H+] maka boleh kita ganti.
![[H^{+}]^{2} = 1 x 10^{-14}](https://latex.codecogs.com/gif.latex?[H^{+}]^{2}&space;=&space;1&space;x&space;10^{-14})
![[H^{+}]=[OH^{-}] = \sqrt{1 x 10^{-14}}](https://latex.codecogs.com/gif.latex?[H^{+}]=[OH^{-}]&space;=&space;\sqrt{1&space;x&space;10^{-14}})
![[H^{+}]=[OH^{-}] =1 x 10^{-7}](https://latex.codecogs.com/gif.latex?[H^{+}]=[OH^{-}]&space;=1&space;x&space;10^{-7})
Misalkan kita tambahkan [H+] = , maka konsentrasi H+ total adalah :
, maka konsentrasi H+ total adalah :
[H+] total = +
+ 
=
pH = - log [H+]
= - log
= 7 - log 6
= 7 - 0,78 = 6,22
Nah terlihat dengan penambahan H+ kedalam air maka pH nya akan menurun menjadi bersifat asam karena jumlah H+ nya bertambah.
Soal 3
Jika dikerahui pOH larutan H2SO4 adalah 11,7 dan log 5 = 0,7, tentukanlah konsentrasi larutan H2SO4 tersebut!
Pembahasan :
Biasanya siswa akan kesulitan jika soalnya diubah sedkit seperti soal diatas. Maka kalian perlu berlatih dan jangan bingung bagaimanan cara menjawabnya.
pOH H2SO4 = 11,7
H2SO3 adalah asam kuat bervalensi 2, sehingga yang kita butuhkan adalah [H+] nya.
pH = pKw - pOH
= 14 - 11,7
= 2,3
Untuk mencari konsentrasi H+ dari pH yang berkoma, memerlukan teknik matematika sebagai berikut :
pH = 2,3 ==> - log H+ = 2,3
- log H+ = 3 - 0,7 (0,7 = log 5)
= 3 - log 5
[H+] = e="5 x 10^{-3}" />
e="5 x 10^{-3}" />
Setelah dapat [H+] nya baru kita cari molaritas H2SO4
[H+] = Valensi x M asam
 = 2 x M asam
= 2 x M asam
M asan = /2 =
/2 =  = 0,0025 M
= 0,0025 M
Soal 4
Sebanyak 3,42 gram Ba(OH)2 dilarutkan dalam 250 mL air. Jika Ar Ba= 137. O = 16 dan H = 1, tentukanlah harga pOH dari larutan tersebut.
Pembahasan :
Nah ini juga sangat mudah sekali. Nanti pada soal soal yang basa, umumnya diketahui dalam massa karena memang senyawa basa kebanyakan bwerujud padat. Yang kita butuhkan untuk mecari pOH adalah [OH-], nah untuk mencari konsentras kita harus cari mol terlebih dahulu.
n Ba(OH2 = gr/ Mr = 3,42 / 171 = 0,02 mol
M Ba(OH)2 = n/V = 0,02 mol/ 0,25 L = 0,08 M =
[OH-] = Valensi x M
= 2 x
=
Soal 5
Sebanyak 100 mL larutan H2SO4 yang pH =1 dimasukkan larutan 400 mL H2SO4 yang pHnya = 2. Hitunglah pH campuran larutan tersebut!
Pembahasan :
Karena yang kita butuhkan untuk menghitung pH campuran asam adalah konsentrasi ion H+, maka kita cari itu terlebih dahulu.
Larutan 1 = pH = 1 ==> [H+] = 0,1 M
n [H+] = M x V = 0,1 M x 100 mL = 10 mmol
Larutan 2 = pH = 2 ==> [H+] = 0,01
n [H+] = M x V = 0,01 x 400 mL = 4 mmol
nH+ total = 10 mmol + 4 mmol = 14 mmol
[H+] campuran = (n H+ total) / V total = 14 mmol / 500 mL = 0,028 M =
pH campuran = - log [H+] campuran = - log = 2 - log 2
= 2 - log 2
Selelai....selamat kalian telah mendapatkan sedikit ilmu dari memahami tulisan ini. Sampai jumpa.
Soal 1
Tentukanlah konsentrasi ion H+ dan OH- dari larutan 0,2 M
Pembahasan :
Nah soal ini sangat mudah sekali, jadi pasti kalian dapat dengan mudah mencarinya.
[OH-] = Valensi basa x M basa kuat
= 2 x 0,2 M
= 0,4 M =
Nah untuk mencari berapa konsentrasi ion H+ dalam larutan tersebut, kita gunakan hubungan pH, pOH dan pKw. Nilai Kw kalian wajib hafal yaitu
[H+] x [OH-] = Kw
[H+] x
[H+] =
=
Nah sangat mudah bukan . . .Ayo kita lanjut soal berikutnya.
Soal 2
Mengapa penambahan ion H+ dalam air menyebabkan air bersifat asam?
Pembahasan :
Mungkin kita pernah memasukkan air jeruk dalam air, maka rasa air akan jadi asam sama seperti rasa jeruk tersebut. Kenapa demikian?? Jawaban sederhananya adalah karena pada air jeruk terdapat ion H+ yang akan menambah jumlah ion H+ dari air sehingga jumlahnya lebih banyak daripada ion OH-. Hal ini menyebabkan larutan bersifat asam.
Untuk membuktikannya marilah kalian perhatikan contoh beriut :
Air ==> pH = 7 ==> artinya [H+] = [OH-]
Pada saat pH sama dengan 7, maka kosentrasi ion H+ akan sama dengan ion OH- yaitu sebgai berikut :
[H+] x [OH-] = Kw
[H+] x [H+] = Kw (karena [OH-] sama dengan [H+] maka boleh kita ganti.
Misalkan kita tambahkan [H+] =
[H+] total =
=
pH = - log [H+]
= - log
= 7 - log 6
= 7 - 0,78 = 6,22
Nah terlihat dengan penambahan H+ kedalam air maka pH nya akan menurun menjadi bersifat asam karena jumlah H+ nya bertambah.
Soal 3
Jika dikerahui pOH larutan H2SO4 adalah 11,7 dan log 5 = 0,7, tentukanlah konsentrasi larutan H2SO4 tersebut!
Pembahasan :
Biasanya siswa akan kesulitan jika soalnya diubah sedkit seperti soal diatas. Maka kalian perlu berlatih dan jangan bingung bagaimanan cara menjawabnya.
pOH H2SO4 = 11,7
H2SO3 adalah asam kuat bervalensi 2, sehingga yang kita butuhkan adalah [H+] nya.
pH = pKw - pOH
= 14 - 11,7
= 2,3
Untuk mencari konsentrasi H+ dari pH yang berkoma, memerlukan teknik matematika sebagai berikut :
pH = 2,3 ==> - log H+ = 2,3
- log H+ = 3 - 0,7 (0,7 = log 5)
= 3 - log 5
[H+] =
Setelah dapat [H+] nya baru kita cari molaritas H2SO4
[H+] = Valensi x M asam
M asan =
Soal 4
Sebanyak 3,42 gram Ba(OH)2 dilarutkan dalam 250 mL air. Jika Ar Ba= 137. O = 16 dan H = 1, tentukanlah harga pOH dari larutan tersebut.
Pembahasan :
Nah ini juga sangat mudah sekali. Nanti pada soal soal yang basa, umumnya diketahui dalam massa karena memang senyawa basa kebanyakan bwerujud padat. Yang kita butuhkan untuk mecari pOH adalah [OH-], nah untuk mencari konsentras kita harus cari mol terlebih dahulu.
n Ba(OH2 = gr/ Mr = 3,42 / 171 = 0,02 mol
M Ba(OH)2 = n/V = 0,02 mol/ 0,25 L = 0,08 M =
[OH-] = Valensi x M
= 2 x
=
Soal 5
Sebanyak 100 mL larutan H2SO4 yang pH =1 dimasukkan larutan 400 mL H2SO4 yang pHnya = 2. Hitunglah pH campuran larutan tersebut!
Pembahasan :
Karena yang kita butuhkan untuk menghitung pH campuran asam adalah konsentrasi ion H+, maka kita cari itu terlebih dahulu.
Larutan 1 = pH = 1 ==> [H+] = 0,1 M
n [H+] = M x V = 0,1 M x 100 mL = 10 mmol
Larutan 2 = pH = 2 ==> [H+] = 0,01
n [H+] = M x V = 0,01 x 400 mL = 4 mmol
nH+ total = 10 mmol + 4 mmol = 14 mmol
[H+] campuran = (n H+ total) / V total = 14 mmol / 500 mL = 0,028 M =
pH campuran = - log [H+] campuran = - log
Selelai....selamat kalian telah mendapatkan sedikit ilmu dari memahami tulisan ini. Sampai jumpa.

Posting Komentar untuk "Soal Essay Menghitung pH Asam dan Basa Kuat + Pembahasan "