Bank Soal UN Kimia SKL Laju Reaksi
Ada 11 buah soal un kimia SKL laju reaksi yang bisa membantu kamu memahami materi ini dnegan baik. Soal-soal ini dibuat mengacu pada SKL UN Kimia yang ada. Kamu juga bisa mengambil file soal dalam format WORD atau PDF melalui tautan yang ada di bagian akhir postingan.
Soal 1
Perhatikanlah grafik untuk asam asetat dalam reaksi :
CH3COOH + C2H5OH ==> CHECOOC2H5 + H2O
Pernyataan berikut yang benar adalah . . . .
A. Konsentrasi CH3COOH tidak berubah
B. Konsentrasi CH3COOH tidak mempengaruhi laju reaksi
C. Laju reaksi menjadi 4 kali lebih besar jika konsentrasi CH3COOH dinaikkan dua kali.
D. Reaksi berlangsung terus menerus
E. Semakin tinggi konsentrasi, maka reaksi akan berlangsung lebih lama.
Soal 2
Gas NO dibakar menjadi gas NO2 menurut persamaan reaksi :
2NO(g) + O2(g) ==> 2NO2(g)
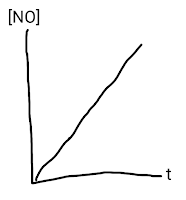
Grafik yang menggambarkan hubungan antara konsentrasi NO terhadap waktu adalah . . . .
A.
B.
Soal 3
Pada percobaab reaksi batu pualan dengan HCl didapatkan data sebagai berikut :
Perc. [HCl] massa. Suhu. Waktu
Pualam (4 g) mnt
1. 2 M. Kerikil. 25. 2
2. 1 M. Kerikil. 25. 5
3. 1 M. Serbuk. 25. 1.5
4. 1 M. Kerikil. 35. 0.5
5. 0.5 M. Serbuk. 25. 4
Laju reaksi percobaan 2 dan 3 dipengaruhi oleh . .
A. Waktu
B. Massa
C. Konsentrasi HCl
D. Luas permukaan pualam
E. Suhu
Soal 4
Setiap kenaikan suhu 29 derajat Celsius, laju reaksi menjadi tiga kali lebih cepat. Jika pada suhu 20 derajat Celsius reaksi berlangsung 27 menit, maka laju reaksi pada suhu 80 derajat Celsius adalah . . . .
A. 9 menit
B. 3 menit
C. 1 menit
D. 1/2 menit
E. 1/3 menit
Soal 5
Untuk reaksi A + B ==> diperoleh data sebagai berikut:
Jika konsentrasi A dinaikkan dua kali pada konsentrasi B tetap, laju reaksi menjadi 4 kali lebih besar. Dan jika konsentrasi A dan B dinaikkan dua kali, maka laju reaksi menjadi 8 kali lebih besar. Persamaan laju reaksi nya adalah . . . .
A. k [A] [B]^2
B. k [A] [B]
C. k [A]^2 [B]
D. k [A]^2 [B]^2
E. k [A] [B]^3
Soal 6
Dari reaksi NO dan Br2 diperoleh data sebagai berikut.
Perc. [NO] [Br2] laju rx (M/det)
1. 0.1. 0.05. 6
2. 0.1. 0.1. 12
3. 0.1. 0.2. 24
4. 0.2. 0.05. 24
5. 0.3. 0.05. 54
Reaksi tersebut adalah reaksi tinggkat. . . .
A. 1
B. 2
C. 3
D. 4
E. 0
Soal 7
Perhatikan dta pada tabel berikut untuk reaksi : A + B ==> C + D
Soal 1
Perhatikanlah grafik untuk asam asetat dalam reaksi :
CH3COOH + C2H5OH ==> CHECOOC2H5 + H2O
Pernyataan berikut yang benar adalah . . . .
A. Konsentrasi CH3COOH tidak berubah
B. Konsentrasi CH3COOH tidak mempengaruhi laju reaksi
C. Laju reaksi menjadi 4 kali lebih besar jika konsentrasi CH3COOH dinaikkan dua kali.
D. Reaksi berlangsung terus menerus
E. Semakin tinggi konsentrasi, maka reaksi akan berlangsung lebih lama.
Soal 2
Gas NO dibakar menjadi gas NO2 menurut persamaan reaksi :
2NO(g) + O2(g) ==> 2NO2(g)
Grafik yang menggambarkan hubungan antara konsentrasi NO terhadap waktu adalah . . . .
A.
B.
C.
D.
E.
Soal 3
Pada percobaab reaksi batu pualan dengan HCl didapatkan data sebagai berikut :
Perc. [HCl] massa. Suhu. Waktu
Pualam (4 g) mnt
1. 2 M. Kerikil. 25. 2
2. 1 M. Kerikil. 25. 5
3. 1 M. Serbuk. 25. 1.5
4. 1 M. Kerikil. 35. 0.5
5. 0.5 M. Serbuk. 25. 4
Laju reaksi percobaan 2 dan 3 dipengaruhi oleh . .
A. Waktu
B. Massa
C. Konsentrasi HCl
D. Luas permukaan pualam
E. Suhu
Soal 4
Setiap kenaikan suhu 29 derajat Celsius, laju reaksi menjadi tiga kali lebih cepat. Jika pada suhu 20 derajat Celsius reaksi berlangsung 27 menit, maka laju reaksi pada suhu 80 derajat Celsius adalah . . . .
A. 9 menit
B. 3 menit
C. 1 menit
D. 1/2 menit
E. 1/3 menit
Soal 5
Untuk reaksi A + B ==> diperoleh data sebagai berikut:
Jika konsentrasi A dinaikkan dua kali pada konsentrasi B tetap, laju reaksi menjadi 4 kali lebih besar. Dan jika konsentrasi A dan B dinaikkan dua kali, maka laju reaksi menjadi 8 kali lebih besar. Persamaan laju reaksi nya adalah . . . .
A. k [A] [B]^2
B. k [A] [B]
C. k [A]^2 [B]
D. k [A]^2 [B]^2
E. k [A] [B]^3
Soal 6
Dari reaksi NO dan Br2 diperoleh data sebagai berikut.
Perc. [NO] [Br2] laju rx (M/det)
1. 0.1. 0.05. 6
2. 0.1. 0.1. 12
3. 0.1. 0.2. 24
4. 0.2. 0.05. 24
5. 0.3. 0.05. 54
Reaksi tersebut adalah reaksi tinggkat. . . .
A. 1
B. 2
C. 3
D. 4
E. 0
Soal 7
Perhatikan dta pada tabel berikut untuk reaksi : A + B ==> C + D
Berdasarkan reaksi diatas orde reaksibtotal adalah . . . .
A. 0
B. 1
C. 2
D. 3
E. 4
Soal 8
Nitrogen oksida, NO, bereaksi dengan hidrogen membentuk dinitrogen oksida N2O dan uap air menurut persamaan:
2NO + H2 ==> N2O + H2O
Pengaruh konsentrasi NO dan H2
terhadap laju reaksi ditemukan sebagai berikut:
Laju reaksi yang terjadi jika konsentrasi NO2 = 2 M dan konsentrasi H2 = 5 M adalah . . . .
A. 1/36
B. 1/18
C. 5/36
D. 5/18
E. 5/9
Soal 10
Kedalam wadah 2 L dimasukkan 0.10 mol gas fosgen yang terurai dengan persamaan reaksi
COCl2 ==> CO + Cl2
Setelah 10 detik, gas yeraebut tinggal 0.02 mol. Laju peruraian gas fosgen adalah . . . .
A. 4 x 10^-3 M/detik
B. 3 x 10^-3 M/detik
C. 2 x 10^-3 M/detik
D. 3 x 10^-2 M/detik
E. 2 x 10^-2 M/detik
Soal 11
Pada percobaan reaksi antara logam aluminium dan larutan asam sulfat sesuai dengan persamaan reaksi :
2Al + 3H2SO4 ==> Al2(SO4)3 + 3H2
Gas hidrogen yang dihasilkan ditampung pada wadah dan diukur volumenya pada suhu tetap. Data pengukuran tiap waktu sebagai berikut :
No. Waktu. Volume
1. 0. 0
2. 15. 40
3. 30. 80
Laju pembentukan gas hidrogen setelah 30 detik sebesar. . . . mL/detik
A. 0.83
B. 1.33
C. 2.67
D. 2.50
E. 7.50
File soal yang bisa kamu dapatkan:







Posting Komentar untuk "Bank Soal UN Kimia SKL Laju Reaksi"