Soal UAS Kimia Semester 1 Kelas 11 SMA + Pembahasan Bagian 6
Assalammualaikum, hay pengunjung blog saya yang saya cintai. Ini adalah seri terakhir dari topik UAS SMA kelas 11 yaitu tentang bab kesetimbangan. Semoga kalian masih semangat karena belajar itu penting. Bukan buat siapa siapa, tapi buat diri kalian sendiri.
Soal 1
Perhatikanlah rekasi kesetimbangan berikut :
2SO2(g) + O2(g) <==> 2SO3(g) = - 197,8 kJ/mol
= - 197,8 kJ/mol
Gambar partikel pada keadaan setimbang mula mula sebagai berikut :
Jika suhu dinaikkan, gambar partikel perekasi kesetimbangan sesaat yang baru adalah . . . . .
Pembahasan
Nah ini adalah salah satu soal yang memakai konsep faktor faktor yang memengaruhi laju reaksi. Pada soal ini yang ditanya adalah pengaruh suhu, maka kalian harus mengetahui jenis reaksi kesetimbangan apakah eksoterm atau endoterm.
Jika suhunya dinaikkan maka kesetimbangan aan bergeser kearah reaksi endoterm dan sebaliknnya jika suhu diturunkan maka kesetimbangan akan bergeser kearah reaksi endoterm.
Pada soal diatas, reaksinya tergolong eksoterm kearah pembentukan SO3 dan endoterm kearah penguraian SO3 ( pembentukan SO2 dan O2). Jika suhu dinaikkan maka kesetimbangan akan bergeser kearah reaksi endoterm yaitu kearah pembentukan SO2 dan O2 yang akan lebih banyak.
Nah, soal ini tidak sampai disini, kita justru diminta menunjukkan dengan gambar mana keadaan ini tepat. Pada soal yang ditanya kan hanya partikel perekasi saja, maka jumlah SO2 dan O2 akan lebih banyak dari semula. Gambar yang menunjuukkan keadaan tersebut yang tepat adalah gambar option C.
Soal 2
Pada reaksi kesetimbangan N2O4(g) <==> 2NO2(g) diperoleh mol N2O4 dan 2NO2 yang sama. Derajat disosiasi dari N2O4 adalah . . . .?
Pembahasan
Pertama kita buat dulu stoikiometri rekasinya ya dengan memisalkan mol N2O4 pada saat setimbang adalah a.
N2O4(g) <==> 2NO2(g)
Mula Mula
Reaksi 1/2 a <== a
Sisa a ==> a
Jika pada saat setimbang terdapat a mol N2O4, maka jumlah mol NO2 yang ada pada saat setimbang juga a mol, karena mol mereka sama. Jika terdapat a mol NO2 pada saat setimbang, maka tentunya pada saat reaksi juga terbentuk a mol NO2 yang semula tidak ada. Dengan menggunakan prinsip perbandingan koefisien, maka kita dapatkan mol N2O4 yang bereaksi adalah 1/2 a mol.
Jumlah mol N2O4 mula mula = Reaksi + sisa = 1/2 a + a = 3/2 a
Derajat disosiasi = mol reaksi / mol mula mula = 1/2 a/ 3/2 a = 1/3
Soal 3
Pada reaksi kesetimbangan : 2NH3(g) ==> N2(g) + 3H2(g) pada suhu 27 derajat Celsius mempunyai harga Kp = 2,46. Harga Kc reaksi tersebut adalah . . . .?
Pembahasan
Ini soal tentang hubungan Kc dengan Kp, yaitu :^{\Delta&space;n})
Karena yang akan dicari Kc, maka rumusnya menjadi :
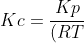^{\Delta&space;n}})
Delta n adalah selisih koefisien produk dan reaktan. Pada reaksi diatas, selisihnya adalah = 4 - 2 = 2
^{2}})
Nah, tinggal kalian cari sendiri hasilnya. Mudah kan.
Soal 4
Harga tetapan kesetimbangan untuk reaksi : 2X(g) <==> 3Y(g) pada temperatur tertentu adalah 1/8. Jika pada saat setimbang tekanan parsial X adalah 8 atm, maka tekanan parsial Y adalah . . . .
Pembahasan :
Kita buat dulu rumus Kp dari reaksi diatas.
^{3}}{P(X)^{2}})
Nah yang ditanya kan tekanan parsial Y, maka rumusnya menjadi seperti ini :
^3&space;=&space;Kp&space;P(X)^{2})
^3&space;=&space;1/8&space;.&space;(8)^{2})
^3&space;=&space;8&space;==>&space;P(Y)&space;=&space;2)
Sumber Soal : Buku PR Kimia Kelas XI SMA, Intan Pariwara
Soal 1
Perhatikanlah rekasi kesetimbangan berikut :
2SO2(g) + O2(g) <==> 2SO3(g)
Gambar partikel pada keadaan setimbang mula mula sebagai berikut :
Jika suhu dinaikkan, gambar partikel perekasi kesetimbangan sesaat yang baru adalah . . . . .
Pembahasan
Nah ini adalah salah satu soal yang memakai konsep faktor faktor yang memengaruhi laju reaksi. Pada soal ini yang ditanya adalah pengaruh suhu, maka kalian harus mengetahui jenis reaksi kesetimbangan apakah eksoterm atau endoterm.
Jika suhunya dinaikkan maka kesetimbangan aan bergeser kearah reaksi endoterm dan sebaliknnya jika suhu diturunkan maka kesetimbangan akan bergeser kearah reaksi endoterm.
Pada soal diatas, reaksinya tergolong eksoterm kearah pembentukan SO3 dan endoterm kearah penguraian SO3 ( pembentukan SO2 dan O2). Jika suhu dinaikkan maka kesetimbangan akan bergeser kearah reaksi endoterm yaitu kearah pembentukan SO2 dan O2 yang akan lebih banyak.
Nah, soal ini tidak sampai disini, kita justru diminta menunjukkan dengan gambar mana keadaan ini tepat. Pada soal yang ditanya kan hanya partikel perekasi saja, maka jumlah SO2 dan O2 akan lebih banyak dari semula. Gambar yang menunjuukkan keadaan tersebut yang tepat adalah gambar option C.
Soal 2
Pada reaksi kesetimbangan N2O4(g) <==> 2NO2(g) diperoleh mol N2O4 dan 2NO2 yang sama. Derajat disosiasi dari N2O4 adalah . . . .?
Pembahasan
Pertama kita buat dulu stoikiometri rekasinya ya dengan memisalkan mol N2O4 pada saat setimbang adalah a.
N2O4(g) <==> 2NO2(g)
Mula Mula
Reaksi 1/2 a <== a
Sisa a ==> a
Jika pada saat setimbang terdapat a mol N2O4, maka jumlah mol NO2 yang ada pada saat setimbang juga a mol, karena mol mereka sama. Jika terdapat a mol NO2 pada saat setimbang, maka tentunya pada saat reaksi juga terbentuk a mol NO2 yang semula tidak ada. Dengan menggunakan prinsip perbandingan koefisien, maka kita dapatkan mol N2O4 yang bereaksi adalah 1/2 a mol.
Jumlah mol N2O4 mula mula = Reaksi + sisa = 1/2 a + a = 3/2 a
Derajat disosiasi = mol reaksi / mol mula mula = 1/2 a/ 3/2 a = 1/3
Soal 3
Pada reaksi kesetimbangan : 2NH3(g) ==> N2(g) + 3H2(g) pada suhu 27 derajat Celsius mempunyai harga Kp = 2,46. Harga Kc reaksi tersebut adalah . . . .?
Pembahasan
Ini soal tentang hubungan Kc dengan Kp, yaitu :
Karena yang akan dicari Kc, maka rumusnya menjadi :
Delta n adalah selisih koefisien produk dan reaktan. Pada reaksi diatas, selisihnya adalah = 4 - 2 = 2
Nah, tinggal kalian cari sendiri hasilnya. Mudah kan.
Soal 4
Harga tetapan kesetimbangan untuk reaksi : 2X(g) <==> 3Y(g) pada temperatur tertentu adalah 1/8. Jika pada saat setimbang tekanan parsial X adalah 8 atm, maka tekanan parsial Y adalah . . . .
Pembahasan :
Kita buat dulu rumus Kp dari reaksi diatas.
Nah yang ditanya kan tekanan parsial Y, maka rumusnya menjadi seperti ini :
Sumber Soal : Buku PR Kimia Kelas XI SMA, Intan Pariwara


Posting Komentar untuk "Soal UAS Kimia Semester 1 Kelas 11 SMA + Pembahasan Bagian 6"