UN Kimia SKL Struktur Atom dan Sistem Periodik : Soal dan Pembahasan
Berikut adalah soal dan pembahasan soal UN Kimia SMA tahun 2015 keatas sehingga masih sangat baik dijadikan media latihan persiapan UN 2016. Akan diabahas secara ringkas dan mudah mengeri.
Soal 1 : Menentukan diagram orbital konfigurasi suatu unsur.
Suatu unsur mempunyai lambang . Diagram orbital dari konfgurasi unsur tersebut adalah . . . .
. Diagram orbital dari konfgurasi unsur tersebut adalah . . . .

 bisa kita gantikan dengan He untuk mempersingkatnya maka konfigurasinya akan menjadi :
bisa kita gantikan dengan He untuk mempersingkatnya maka konfigurasinya akan menjadi : ![[He]\: 2s^{2}\: 2p^{5}](https://latex.codecogs.com/gif.latex?[He]\:&space;2s^{2}\:&space;2p^{5})



Orbital selain 5s^1 telah terisi penuh dengan elektron dengan jumlah orbital subkulit s = 1, p = 3 dan d = 5.
Jumlah orbital keseluruhan adalah = 1 + 1 + 3 + 1 + 3 + 1 + 5 + 3 = 18
Jawaban : C
Soal 6 : Mengurutkn unsur berdasarkan kecendrungan sifat keperiodikannya (Energi ionisasi, Afinitas elektron, Jari jari, Keelektronegatifan dll)
Energi ionisasi He, Ne Ar, Kr dan Xe secara acak adalah 2080 kJ/mol, 1520 kJ/mol, 1170 kJ/mol, 1350 kJ/mol dan 2372 kJ/mol. Berdasarkan data tersebut harga energi nionisasi unsur Kr adalah . . . .
A. 2375
B. 2080
C. 1520
D. 1350
E. 1170
Pembahasan :
Dari atas kebawah (He ==> Xe) jari jari semakin besar karena jumlah kulit bertambah. Jika jari jari semakin besar, maka jarar inti terhadap elektron terluar akan semakin jauh. Akibatnya gaya tarik inti terhadap elektron tersebut semakin kecil sehingga elektron mudah lepas. Jika semakin mudah elektron lepas berarti energi ionisasinya akan semakin kecil. Jadi dari atas ke bawah dalam datu golongan energi ionisasi akan semakin kecil.
He = 2375 kJ/mol
Ne = 2080 kJ/mol
Ar = 1520 kJ/mol
Kr = 1350 kJ/mol
Xe = 1170 kJ/mol
Prnsip mengurutkan unsur berdasarkan data yang diberikan secara acak akan sama untuk sifat keperiodikan yang lain.
Jawaban : D
Soal 7 : Menentukan pengisian elektron yang sesuai atau tidak sesuai dengan aturan pengisisan elektron (Aufbau dan Hund)
Pengisian elektron dalam orbital unsur sebagai berikut:
Pengisian elektron yang sesuai dengan aturan Hund dan Aufbau ditunjukkan oleh nomor . . . . (Nomor atom Ne = 10, orbital dengan satu kotak = 3s, tiga kotak = 3p)
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan :
Aturan Aufbau = Pengisian elektron dimulai dari orbital dengan tinggakt energi terendah.
Aturan Hund = elektron diisi pada orbital dengan spin yang sama terlebih dahulu, kemudian baru spin yang berbeda.
Pengisian elektron no 1, salah karena setelah Ne, harusnya diisi terlebih dahulu orbital 3s baru kemudian 3p. Sedangkan yang nomor 3 juga salah karena harusnya pada orbital 3p tersebut tidak diisi berpasangan terlebih dahulu melainkan diisi seluruh orbital terlebih dahulu kemudian jika bersisa baru dipasangkan.
No 2 dan 4 sesuai dengan aturan Aufbau dan Hund.
Jawaban : D
Soal 8 : Menentukan Letak Unsur Dalam Suatu Sistem Periodik Jika Diketahui nomor atomnya.
Beberapa unsur terletak dalam tabel periodik berikut!
Unsur dengan nomor atom 29 ditunjukkan oleh . . . .
A. M
B. N
C. O
D. P
E. Q
Pembahasan :
Unsur dengan nomor atom 29, konfigurasi elektronnya adalah sebagai berikut :
=![[Ar]4s^{1}3d^{10}](https://latex.codecogs.com/gif.latex?[Ar]4s^{1}3d^{10})
Kulit valensi =
Karena ujung konfigurasinya berakhir di orbital d maka unsur tersebut pasti golongan B. Dari sini saja kalian sudah pasti tahu jawabnnya yaitu O karena satu satunya unsur golongan B yang diketahui. Tapi tidak ada salahnya kita mencari golongan dan periodenya
Jumlah elektron valensi = 1 + 10 = 11 ==> IB ==> atom O
Periode = 4
Jawaban : C
Tapi kalau kalian bahkan malas membuat konfigurasinya, hitung saja nomor atom mana yang 29. Hitungnya mulai dari kiri paling atas ke kanan.
Soal 9 :Menentukan Grafik perubahan energi ionisasi beberapa atom.
Unsur P, Q, R dan S terletak pada satu golongan. Nomor atom unsur tersebut secara berturut turut adalah 3, 11, 19 dan 37. Berdasarkan nomor atom tersebut, hubungan antara nomor atom dengan energi ionisasinya digambarkan oleh grafik . . . .
Soal 1 : Menentukan diagram orbital konfigurasi suatu unsur.
Suatu unsur mempunyai lambang
Pembahasan :
Soal diatas tergolong mudah, karena berhubungan dengan konsep dasar dalam kimia. Konsep yang perlu kalian ingat :
1. Prinsip Aufbau : Mengisi elektron dimulai dari orbital dengan energi paling rendah.
2. Aturan Hund : Mengisi elektron pada orbital dengan tinggkat energi sama, diisi dengan spin + terlebih dahulu kemudian baru dengan spin -.
Nomor atom = 9
Konfigurasi elektron = 
Diagram orbitalnya :
Perhatikanlah diagram orbital diatas, dimana untuk 2p5, diisi terlebih dahulu spin yang positif, kemudian baru yang negatif sehingga terdapat 1 buah elektron tidak berpasangan.
Jawaban : D
Soal 2 : Menentukan Golongan Dan Periode Suatu Unsur
Perhatikan notasi unsur berikut!
Konfigurasi elektron , golongan dan periode unsur Z yang tepat adalah. . . . (Nomor atom Ne = 10)
Konfigurasi Elektron Golongan Periode
A. ![[Ne]\: 3s^{2}\: 3p^{3}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;[Ne]\:&space;3s^{2}\:&space;3p^{3}) VA 3
VA 3
B. ![[Ne]\: 3s^{2}\: 3p^{4}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;[Ne]\:&space;3s^{2}\:&space;3p^{4}) IIA 2
IIA 2
C. ![[Ne]\: 3s^{2}\: 3p^{4}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;[Ne]\:&space;3s^{2}\:&space;3p^{4}) VIA 3
VIA 3
D. ![[Ne]\: 3s^{2}\: 3p^{5}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;[Ne]\:&space;3s^{2}\:&space;3p^{5}) VIIA 3
VIIA 3
E. ![[Ne]\: 3s^{2}\: 3p^{5}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;[Ne]\:&space;3s^{2}\:&space;3p^{5}) VA 2
VA 2
Pembahasan :
Nah yang kita butuhkan untuk membuat konfigurasi serta mencari golongan dan adalah jumlah elektron. Dari notasi unsur Z :
Nomor atom = 17 = Jumlah Proton = Jumlah Elektron
Nomor Massa = 35,5 = Jumlah proton + Jumlah Neutron
Konfigurasi unsur Z =  {2}\: 3p^{5}" />
{2}\: 3p^{5}" />
Atau dapat disingkat dengan menggunakan atom Ne dengan nomor atom 10, sehingga konfigurasinya dapat ditulis menjadi = ![[Ar]\: 3s^{2} \: 3p^{5}](https://latex.codecogs.com/gif.latex?[Ar]\:&space;3s^{2}&space;\:&space;3p^{5})
Kulit valensi = 
Karena konfigurasi elektronnya berakhir di orbital s dan p maka unsur Z adalah unsur golongan A.
Jumlah elektron valensi = 2 + 5 = 7 ==> Golongan VIIA
Periode = Bilangan kuantum utama (n) tertinggi = 3
Jawaban : D
Soal 3 : Menentukan letak suatu unsur dalam sistem periodik jika diketahui konfigurasi ionnya
Konfigurasi elektron ion 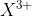 adalah
adalah  . Dalam sistem periodik unsur, unsur Y terletak pada . . . .
. Dalam sistem periodik unsur, unsur Y terletak pada . . . .
A. Periode 3 golongan IA
B. Periode 3 golongan VIA
C. Periode 4 golongan IIB
D. Periode 4 golongan VB
E. Periode 4 golongan VIB
Pembahasan :
Konfigurasi ion yang diketahui diatas adalah konfigurasi ion positif. Ion positif terbentuk setelah atomnya melepaskan sejumlah elektron. +3 artinya ada 3 buat elektron yang dilepaskan oleh atom netral X sehingga menjadi ion 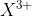 .
.
Jumlah elektron ion 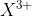 = 21 (setelah melepas 3 buah elektron)
= 21 (setelah melepas 3 buah elektron)
Jumlah elektron atom X = 21 + 3 = 24
Konfigurasi elektron atom X = 
Kulit valensi = 
Jumlah elektron valensi = 2 + 4 = 6 ==> karena berakhir orbital d, maka unsur X adalah unsur golongan VIB.
Yang perlu kalian ingat tentang menentukan golongan unsur golongan B adalah jika elektron valensinya 8, 9, 10 adalah golongan VIIIB, jika eektron valensinya 11, maka termasuk golongan IB dan elektron valensinya 12 termasuk golongan IIB. Untuk elektron valensi yang lain, jumlah elektron valensinya akan sama dengan nomor golongannya.
Soal 4 : Menentukan Unsur Tertentu Berdasarkan Harga Bilangan Kuantumnya
Elektron terakhir dari suatu atom unsur memiliki bilangan kuantum n = 5, l = 2, m = +2 , dan s = - 1/2. Unsur yang dimaksud adalah . . . .
A.
B.
C.
D.
E.
Pembahasan :
Mencoba satu satu membuat konfigurasi elektron masing masing atom dalam option diatas kemudian menentukan bilangan kuantum elektron trakhir yang cocok dengan yang diketahui pada soal tentu adalah pekerjaan yang memakan waktu lama bukan.
Untuk itu kita akan mencari atomnya dari data bilangan kuantum yang diketahui.
n = 5
l = 2 ==> d
Maka orbital terakhir atom tersebut adalah 5d
m = +2, kita gambar diagram orbitalnya :
Nilai m = +2 , maka elektron akan terisi sampai kotak terakhir dari diagram orbital d diatas. Karena nilai s = -1/2, maka seluruh kotak akan terisi oleha dua elektron, karena pengisian elektron dalam orbital orbital dimulai dengan spin + terlebih dahulu baru yang negatif.
Setelah mendapatkan orbital terakhir yaitu 5d^10, langkah selanjutnya adalah melengkapi konfigurasi elektron unsur sebelum orbital 5d^10 itu, yaitu sebagai berikut : ![[Xe]6s^{2}4f^{14}5s^{10}](https://latex.codecogs.com/gif.latex?[Xe]6s^{2}4f^{14}5s^{10}) , dengan Xe adala atom gas mulia dengan jumlah elektron 54.
, dengan Xe adala atom gas mulia dengan jumlah elektron 54.
Jumlah elektron total = 54 + 2 + 14 + 10 = 80, berarti atom yang cocok adalah  .
.
Jawaban : C
Soal 5: Menentukan jumlah orbital yan berisis elektron berpasangan dari suatu atom yang diketahui bilangan kuantum elektron terakhirnya.
Suatu unsur P mempunyai harga bilangan kuantum elektron terakhir adalah n = 5, l = 0, m = 0 dan s = +1/2. Jumlah orbital yang berisi elektron berpasangan sebanyak. . . . .
A. 12
B. 15
C. 18
D. 23
E. 24
Pembahasan :
Jika n = 5 dan l = 0 maka orbital terakhir itu adalah 5s.
Karena s memiliki nilai l = 0, maka nilai m nya tentu juga hanya ada 1 yaitu 0. Karena nilai m ada 1 maka jumlah kotak untuk s buah. Nilai bilangan kuantum spinnya = +1/2, berarti hanya ada 1 buah eletron pada orbital terakhir atom P tersebut dengan arah keatas. Berdasarkan penalaran ini maka orbital terakhir dari atom P adalah :
Langkah selanjutnya adalah tinggal melengkapi konfigurasi elektron sebelum 5s^1.
Orbital selain 5s^1 telah terisi penuh dengan elektron dengan jumlah orbital subkulit s = 1, p = 3 dan d = 5.
Jumlah orbital keseluruhan adalah = 1 + 1 + 3 + 1 + 3 + 1 + 5 + 3 = 18
Jawaban : C
Soal 6 : Mengurutkn unsur berdasarkan kecendrungan sifat keperiodikannya (Energi ionisasi, Afinitas elektron, Jari jari, Keelektronegatifan dll)
Energi ionisasi He, Ne Ar, Kr dan Xe secara acak adalah 2080 kJ/mol, 1520 kJ/mol, 1170 kJ/mol, 1350 kJ/mol dan 2372 kJ/mol. Berdasarkan data tersebut harga energi nionisasi unsur Kr adalah . . . .
A. 2375
B. 2080
C. 1520
D. 1350
E. 1170
Pembahasan :
Dari atas kebawah (He ==> Xe) jari jari semakin besar karena jumlah kulit bertambah. Jika jari jari semakin besar, maka jarar inti terhadap elektron terluar akan semakin jauh. Akibatnya gaya tarik inti terhadap elektron tersebut semakin kecil sehingga elektron mudah lepas. Jika semakin mudah elektron lepas berarti energi ionisasinya akan semakin kecil. Jadi dari atas ke bawah dalam datu golongan energi ionisasi akan semakin kecil.
He = 2375 kJ/mol
Ne = 2080 kJ/mol
Ar = 1520 kJ/mol
Kr = 1350 kJ/mol
Xe = 1170 kJ/mol
Prnsip mengurutkan unsur berdasarkan data yang diberikan secara acak akan sama untuk sifat keperiodikan yang lain.
Jawaban : D
Soal 7 : Menentukan pengisian elektron yang sesuai atau tidak sesuai dengan aturan pengisisan elektron (Aufbau dan Hund)
Pengisian elektron dalam orbital unsur sebagai berikut:
Pengisian elektron yang sesuai dengan aturan Hund dan Aufbau ditunjukkan oleh nomor . . . . (Nomor atom Ne = 10, orbital dengan satu kotak = 3s, tiga kotak = 3p)
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan :
Aturan Aufbau = Pengisian elektron dimulai dari orbital dengan tinggakt energi terendah.
Aturan Hund = elektron diisi pada orbital dengan spin yang sama terlebih dahulu, kemudian baru spin yang berbeda.
Pengisian elektron no 1, salah karena setelah Ne, harusnya diisi terlebih dahulu orbital 3s baru kemudian 3p. Sedangkan yang nomor 3 juga salah karena harusnya pada orbital 3p tersebut tidak diisi berpasangan terlebih dahulu melainkan diisi seluruh orbital terlebih dahulu kemudian jika bersisa baru dipasangkan.
No 2 dan 4 sesuai dengan aturan Aufbau dan Hund.
Jawaban : D
Soal 8 : Menentukan Letak Unsur Dalam Suatu Sistem Periodik Jika Diketahui nomor atomnya.
Beberapa unsur terletak dalam tabel periodik berikut!
Unsur dengan nomor atom 29 ditunjukkan oleh . . . .
A. M
B. N
C. O
D. P
E. Q
Pembahasan :
Unsur dengan nomor atom 29, konfigurasi elektronnya adalah sebagai berikut :
=
Kulit valensi =
Karena ujung konfigurasinya berakhir di orbital d maka unsur tersebut pasti golongan B. Dari sini saja kalian sudah pasti tahu jawabnnya yaitu O karena satu satunya unsur golongan B yang diketahui. Tapi tidak ada salahnya kita mencari golongan dan periodenya
Jumlah elektron valensi = 1 + 10 = 11 ==> IB ==> atom O
Periode = 4
Jawaban : C
Tapi kalau kalian bahkan malas membuat konfigurasinya, hitung saja nomor atom mana yang 29. Hitungnya mulai dari kiri paling atas ke kanan.
Soal 9 :Menentukan Grafik perubahan energi ionisasi beberapa atom.
Unsur P, Q, R dan S terletak pada satu golongan. Nomor atom unsur tersebut secara berturut turut adalah 3, 11, 19 dan 37. Berdasarkan nomor atom tersebut, hubungan antara nomor atom dengan energi ionisasinya digambarkan oleh grafik . . . .
Pembahasan :
Kita bisa urutkan dalam satu golongan atom atom diatas sebagau berikut :
P 3
Q 11
R 19
S 37
Dari atas kebawah dalam satu golongan jari jari atom akan semakin besar. Hal ini mengakibatkan jarak inti terhadap elektron terluar akan semakin jauh sehingga gaya tariknya kecil.
Energi ionisasi adalah energi untuk melepaskan sebuah elektron terluar dari suatu atom. Semakin kecil gaya tarik inti terhadap elektron terluar tentu semakin kecil energi ionisasinya. Nah berdasarkan hal ini, maka dapat kita simpulkan bahwa semakin besar nomor atom dalam satu golongan maka akan semakin kecil energi ionisasinya.
Jawaban : C
Soal 10 : Menentukan Konfigurasi Ion dari Suatu Atom
Notasi suatu unsur adalah  , konfigurasi elektron ion
, konfigurasi elektron ion 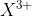 adalah . . . .
adalah . . . .
A. 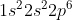
B.
C.
D.
E.
Pembahasan :
Atom X diatas memiliki nomor atom 13 artinya jumlah elektronnya juga 13. Ketika membentuk ion 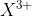 , maka atom X akan melepaskan 3 buah elektronnya sehingga jumlah elektron padaion
, maka atom X akan melepaskan 3 buah elektronnya sehingga jumlah elektron padaion 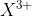 adalah 10. Nah setelah itu tinggal buat konfigurasinya.
adalah 10. Nah setelah itu tinggal buat konfigurasinya.
Konfigurasi elektron ion 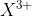 =
= 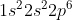
Jawaban : A








Posting Komentar untuk "UN Kimia SKL Struktur Atom dan Sistem Periodik : Soal dan Pembahasan"