Jelaskan Cara Mengambar Diagram Orbital dan Cara Mengisi Elektron Di Dalam Orbital!
Artikel ini menjelaskan tentang cara membuat diagram orbital dan cara mengisi elektron di dalam orbital beserta aturan-aturannya.
Dalam ilmu kimia, orbital biasanya dilambangkan dengan kotak - kotak yang dapat diisi oleh elektron yang dilambangkan dengan tanda panah.
Setiap nilai m mewakili satu orbital.
Pada:
Sub kulit s ⇒ m = 0 = 1 orbital
Sub kulit p ⇒ m = -1, 0, +1 = 3 orbital
Sub kulit d ⇒ m = -2, -1, 0, +1, + 2 = 5 orbital
Sub kulit f ⇒ m = -3, -2, -1, 0, +1, + 2, +3 = 7 orbital
Dan seterusnya……….
Setiap orbital hanya dapat diisi oleh dua buah elektron saja dengan spin yang berlawanan. Maka, jumlah maksimal elektron pada masing-masing sub kulit adalah:
s = 2 elektron
p = 6 elektron
d = 10 elektron
Dan seterusnya………
Dalam mengisi elektron pada kotak - kotak orbital, kita harus mengikuti aturan Hund yaitu sebagai berikut:
Elektron diisi pada setiap orbital dengan spin yang positif terlebih dahulu. Jika ada elektron sisa, baru diisi dengan spin yang yang negatif.
Pembahasan:
4s^2
4s^2 terdiri dari satu orbital (sub kulit s). Karena hanya punya satu orbital, dua elektron pada 4s^2 mengisi penuh orbital dengan spin yang berlawanan. Diagram orbital 4s^2 adalah:
3p^5
3p^5 terdiri dari tiga orbital (sub kulit p) dan kedalamannya akan dimasukkan lima buah elektron. Maka, kita isi dulu masing-masing orbital dengan satu buah elektron yang spinnya positif (dilambangkan dengan anak panah keatas).
Setelah itu, sisa dua elektronnya baru kita isi dengan spin yang berbeda (anak panah kebawah).
Baik elektron dengan spin positif maupun negatif harus diisi dari orbital yang paling kiri. Tidak boleh dari tengah atau dari kanan.
Maka, diagram orbital untuk 3p^5 adalah:
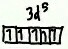
3d^7
3d^7 terdiri dari lima orbital (sub kulit d). Sama seperti contoh diatas, pengisian elektron dimulai dari yang spin positif, kemudian baru yang negatif.
Maka, diagram orbital untuk 3d^7 adalah:
Nah, mudah bukan! Jadi, yang yang perlu kita perhatikan dalam mengambar diagram orbital adalah jenis sub kulit (apakah s, p, d atau f) dan jumlah elektronnya.
C (6)
Sc (21)
Pembahasan:
Untuk membuat diagram orbital, kita harus membuat konfigurasi elektron dari unsur-unsur di atas terlebih dahulu.
Konfigurasi elektron dari:
C (6) = 1s^2 2s^2 2p^2
Sc (21) = 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^1
Setelah itu gambarkan, kotak-kotak orbital di bawah setiap konfigurasi elektron dari unsur-unsur di atas dan sesuaikan jumlah kotaknya untuk masing-masing orbital.
Maka diagram orbital dari C dan Sc adalah:
Pembahasan:
Cara mengerjakan soal ini sama dengan soal diatas. Tapi kita hanya disuruh untuk membuat diagram orbital dari elektron valensinya. Elektron valensi adalah elektron terakhir dari suatu unsur dan kulit yang ditempati oleh elektron valensi disebut dengan kulit valensi.
Dalam menentukan kulit valensi lebih baik kita menyingkat konfigurasi elektronnya menggunakan unsur gas mulia karena akan langsung kulit valensi dari unsur tersebut.
Konfigurasi elektron dari unsur dengan nomor atom 14 adalah:
1s^2 2s^2 2p^6 3s^2 atau [Ne] 3s^2
Kulit valensi = 3s^2
Diagram orbitalnya:
Pembahasan:
Dari diagram orbital kita bisa mengetahui jumlah orbital yang betisi berpasangan maupun tidak berpasangan dari suatu unsur.
Langkah pertama yang perlu dilakukan adalah membuat konfigurasi elektron Mn.
Konfigurasi Mn (25)
1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^5
Perhatikan konfigurasi elektron diatas. Jika dilihat, dari 1s ke 4s, setiap orbitalnya terisi penuh oleh elektron. Berarti, orbital dari 1s hingga 4s terisi penuh oleh elektron berpasangan.
Maka, jumlah orbital tersebut adalah:
= 1 + 1 + 3 + 1 + 3 + 1
= 10 orbital
Selanjutnya, kita hanya perlu membuat diagram orbital 3d^5-nya. Orbital pada 3d^5 ini tidak terisi penuh oleh elektron.
Maka, jumlah orbital yang berisi elektron tidak berpasangan adalah 5 buah.
Pembahasan:
Konfigurasi elektron Cr
1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^4
Jika kamu membuat konfigurasi Cr seperti yang saya buat diatas, kamu akan salah dalam menentukan jumlah elektron tidak berpasangan pada Cr.
Mengapa begitu?
Soalnya, konfigurasi elektron untuk unsur seperti Cr dan Cu (29) lebih stabil pada keadaan penuh dan setengah penuh.
Konfigurasi elektron yang tepat untuk Cr adalah:
1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5
Karena dari 1s ke 3p, orbitalnya terisi penuh oleh elektron, maka kita tidak perlu membuat diagram orbitalnya.
Cukup membuat diagram orbital dari 4s^1 3d^5
Jumlah elektron tidak berpasangan pada unsur Cr adalah 6 buah.
Sekian penjelasan tentang cara menggambar dan mengisi elektron dalam orbital. Semoga bermanfaat.
Apa Itu Diagram Orbital?
Orbital adalah daerah disekitar inti atom tempat kebolehjadian menemukan elektron. Secara sederhana kita dapat menggambarkan suatu orbital yang ditempati elektron menggunakan diagram orbital.Dalam ilmu kimia, orbital biasanya dilambangkan dengan kotak - kotak yang dapat diisi oleh elektron yang dilambangkan dengan tanda panah.
Cara Membuat Diagram Orbital
Jumlah orbital yang dimiliki oleh masing-masing sub kulit atom bergantung pada nilai m atau bilangan kuantum magnetiknya.Setiap nilai m mewakili satu orbital.
Pada:
Sub kulit s ⇒ m = 0 = 1 orbital
Sub kulit p ⇒ m = -1, 0, +1 = 3 orbital
Sub kulit d ⇒ m = -2, -1, 0, +1, + 2 = 5 orbital
Sub kulit f ⇒ m = -3, -2, -1, 0, +1, + 2, +3 = 7 orbital
Dan seterusnya……….
Setiap orbital hanya dapat diisi oleh dua buah elektron saja dengan spin yang berlawanan. Maka, jumlah maksimal elektron pada masing-masing sub kulit adalah:
s = 2 elektron
p = 6 elektron
d = 10 elektron
Dan seterusnya………
Dalam mengisi elektron pada kotak - kotak orbital, kita harus mengikuti aturan Hund yaitu sebagai berikut:
Elektron diisi pada setiap orbital dengan spin yang positif terlebih dahulu. Jika ada elektron sisa, baru diisi dengan spin yang yang negatif.
Contoh:
Buatlah diagram orbital dari 4s^2, 3p^5 dan 3d^7!Pembahasan:
4s^2
4s^2 terdiri dari satu orbital (sub kulit s). Karena hanya punya satu orbital, dua elektron pada 4s^2 mengisi penuh orbital dengan spin yang berlawanan. Diagram orbital 4s^2 adalah:
3p^5
3p^5 terdiri dari tiga orbital (sub kulit p) dan kedalamannya akan dimasukkan lima buah elektron. Maka, kita isi dulu masing-masing orbital dengan satu buah elektron yang spinnya positif (dilambangkan dengan anak panah keatas).
Setelah itu, sisa dua elektronnya baru kita isi dengan spin yang berbeda (anak panah kebawah).
Baik elektron dengan spin positif maupun negatif harus diisi dari orbital yang paling kiri. Tidak boleh dari tengah atau dari kanan.
Maka, diagram orbital untuk 3p^5 adalah:
3d^7
3d^7 terdiri dari lima orbital (sub kulit d). Sama seperti contoh diatas, pengisian elektron dimulai dari yang spin positif, kemudian baru yang negatif.
Maka, diagram orbital untuk 3d^7 adalah:
Nah, mudah bukan! Jadi, yang yang perlu kita perhatikan dalam mengambar diagram orbital adalah jenis sub kulit (apakah s, p, d atau f) dan jumlah elektronnya.
Contoh Soal dan Pembahasan Berkaitan Dengan Menggambar Diagram Orbital
Contoh Soal 1
Gambarkahlah diagram orbital untuk unsur-unsur berikut.C (6)
Sc (21)
Pembahasan:
Untuk membuat diagram orbital, kita harus membuat konfigurasi elektron dari unsur-unsur di atas terlebih dahulu.
Konfigurasi elektron dari:
C (6) = 1s^2 2s^2 2p^2
Sc (21) = 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^1
Setelah itu gambarkan, kotak-kotak orbital di bawah setiap konfigurasi elektron dari unsur-unsur di atas dan sesuaikan jumlah kotaknya untuk masing-masing orbital.
Maka diagram orbital dari C dan Sc adalah:
Contoh Soal 2
Diagram orbital untuk elektron valensi dari unsur dengan nomor atom 14 adalah…………Pembahasan:
Cara mengerjakan soal ini sama dengan soal diatas. Tapi kita hanya disuruh untuk membuat diagram orbital dari elektron valensinya. Elektron valensi adalah elektron terakhir dari suatu unsur dan kulit yang ditempati oleh elektron valensi disebut dengan kulit valensi.
Dalam menentukan kulit valensi lebih baik kita menyingkat konfigurasi elektronnya menggunakan unsur gas mulia karena akan langsung kulit valensi dari unsur tersebut.
Konfigurasi elektron dari unsur dengan nomor atom 14 adalah:
1s^2 2s^2 2p^6 3s^2 atau [Ne] 3s^2
Kulit valensi = 3s^2
Diagram orbitalnya:
Contoh Soal 3
Jumlah orbital dengan elektron berpasangan dan yang tidak berpasangan pada unsur Mn (25) adalah……..Pembahasan:
Dari diagram orbital kita bisa mengetahui jumlah orbital yang betisi berpasangan maupun tidak berpasangan dari suatu unsur.
Langkah pertama yang perlu dilakukan adalah membuat konfigurasi elektron Mn.
Konfigurasi Mn (25)
1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^5
Perhatikan konfigurasi elektron diatas. Jika dilihat, dari 1s ke 4s, setiap orbitalnya terisi penuh oleh elektron. Berarti, orbital dari 1s hingga 4s terisi penuh oleh elektron berpasangan.
Maka, jumlah orbital tersebut adalah:
= 1 + 1 + 3 + 1 + 3 + 1
= 10 orbital
Selanjutnya, kita hanya perlu membuat diagram orbital 3d^5-nya. Orbital pada 3d^5 ini tidak terisi penuh oleh elektron.
Maka, jumlah orbital yang berisi elektron tidak berpasangan adalah 5 buah.
Contoh Soal 4
Jumlah elektron tidak berpasangan pada Cr (24) adalah….Pembahasan:
Konfigurasi elektron Cr
1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^4
Jika kamu membuat konfigurasi Cr seperti yang saya buat diatas, kamu akan salah dalam menentukan jumlah elektron tidak berpasangan pada Cr.
Mengapa begitu?
Soalnya, konfigurasi elektron untuk unsur seperti Cr dan Cu (29) lebih stabil pada keadaan penuh dan setengah penuh.
Konfigurasi elektron yang tepat untuk Cr adalah:
1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5
Karena dari 1s ke 3p, orbitalnya terisi penuh oleh elektron, maka kita tidak perlu membuat diagram orbitalnya.
Cukup membuat diagram orbital dari 4s^1 3d^5
Jumlah elektron tidak berpasangan pada unsur Cr adalah 6 buah.
Contoh Soal 5
Unsur X dengan nomor massa 56 memiliki 30 neutron. Jumlah orbital yang berisi electron berpasangan dan tidak berpasangan dari atom X adalah…….
A. 11 dan 4
B. 11 dan 3
C, 10 dan 4
D, 10 dan 3
E, 9 dan 4
Pembahasan:
Langkah pertama yang akan kita lakukan agar dapat menjawab soal ini adalah mencari jumlah electron yang dimiliki oleh unsur X.
Nomor massa = 56
Neutron = 30
Berarti, jumlah electron unsur X adalah:
= nomor massa – jumlah neutron
= 56 – 30
= 26
Selanjutnya, membuat konfigurasi electron unsur X yang memiliki 26 elektron.
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Langkah terakhir adalah menggambar diagram orbital berdasarkan konfigurasi electron diatas. Sebelumnya kan udah dijelasin jumlah maksimum electron yang ada pada sub kulit s, p, d dan f. kalua kita lihat dari konfigurasi electron diatas, dari 1s sampai 4s sudah terisi electron dengan jumlah maksimal. Jadi, orbital-orbital ini pasti berisi electron berpasangan. Jumlahnya adalah:
= 1 + 1 + 3 + 1 + 3 + 1
= 10 orbital
Selanjutnya, kita tinggal menggambar diagramorbital untuk 3d6 untuk mengetahui berapa banyak orbital yang berisi electron menyendiri.
Diagram orbital 3d6
Dari gambar diatas dapat kamu lihat bahwa pada sub kulit 3d6 terdapat satu orbital dengan electron berpasangan dan 4 orbital dengan electron menyendiri. Sehingga secara total, jumlah orbital dengan electron berpasangan dan tidak berpasangan dari unsur X adalah: 11 dan 4
Kunci Jawaban : A
Contoh soal 5
Unsur P memiliki 15 buah orbital berisi electron berpasangan dan 3 buah orbital dngan electron menyendiri. Nomor atom dari unsur P tersebut adalah…
29
30
31
32
33
Pembahasan:
Soal ini merupakan kebalikan dari soal-soal sebelumnya. Sekarang yang diatanyakan adalah nomor atom, jika diketahui jumlah orbital yang berisi electron berpasangan dan tidak berpasangan.
Langkah pertama, kita mulai dahulu dari data jumlah orbital dengan electron berpasangan milik unsur P yang ada 15 buah. Konfigurasi electronnya adalah sebagai berikut.
1s2 2s2 2p6 3s2 3p6 4s2 3d10
Dari 1d ke 3d, total ada 15 buah orbital yang berisi electron berpasangan.
Selanjutnya, unsur P memiliki 3 buah orbital yang berisi electron menyendiri. Kemungkinan. Orbital selanjutnya setelah 3d adalah 4p. maka, jumlah electron pada orbital 4p ini hanya ada 3 buah. Dengan begitu, jumlah electron menyendirinya sesuai dengan yang disebutkan pada soal.
Konfigurasi leketron lengkap dari unsur P menjadi:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
Sehingga nomor atom unsur P= 2 + 2 + 6 + 2 + 6 + 2 + 10 + 3 = 33
Kunci Jawaban: E
Sekian penjelasan tentang cara menggambar dan mengisi elektron dalam orbital. Semoga bermanfaat.
List Postingan Terkait Bab Struktur Atom
Teori Atom
- Teori Atom Dalton
- Teori atom Thomson
- Teori atom Rutherford
- Teori Atom Bohr
Contoh Soal
- Contoh Soal dan Pembahasan Tentang Teori Atom
- Contoh Soal 1
- Contoh Soal 2
- Contoh Soal dan Pembahasan Tentang Konfigurasi elektron
Bilangan Kuantum
- Contoh Soal Pilihan Ganda Bilangan Kuantum
- Menentukan Bilangan KUantum Mana Yang Mungkin Dimiliki Oleh Suatu elektron
- Jenis-Jenis, Fungsi, Serta Nilai Masing-Masing Bilangan Kuantum
- Cara Menentukan Nilai Keempat Bilangan Kuantum elektron Terakhir Suatu Elektron
Diagram Orbital
- Menentukan Letak Unsur Dalam Tabel Periodik Jika Diketahui JUmlah ELKtron Berpasangan Atau Tidak Berpasangannya
Contoh Soal Struktur Atom Secara Keseluruhan
- Contoh Soal 1
- Contoh Soal 2
- Contoh Soal 3
- Contoh Soal 4







Posting Komentar untuk "Jelaskan Cara Mengambar Diagram Orbital dan Cara Mengisi Elektron Di Dalam Orbital! "