Menggambar Struktur Lewis NaCl, MgCl2 dan Mg3N2 (Senyawa Ion)
Bagaimana menggambar struktur lewis dari senyawa ion seperti natrium klorida (NaCl), magnesium klorida (MgCl2) dan magnesium nitrida (Mg3N2)? Apakah sama dengan senyawa kovalen? Mari cari tahu lewat penjelasan di bawah ini.
Pembentukan senyawa ion sangat berbeda dengan senyawa kovalen. Senyawa ion terbentuk akibat serah terima elektron antara satu unsur dengan unsur lainnya.
Unsur yang yang melepaskan elektron akan bermuatan positif, sedangkan yang menangkap elektron akan bermuatan negatif.
Gaya tarik menarik/elektrostatik antara ion positif dan ion negatif inilah yang disebut dengan ikatan ion.
Karena tidak terbentuk dari pemakaian bersama pasangan elektron, maka struktur Lewis dari senyawa ion berbeda pula dengan senyawa kovalen. Dari penjelasan di bawah ini kamu akan belajar bagaimana cara menulis struktur Lewis untuk senyawa ion.
Senyawa ion yang akan kita buatkan struktur Lewisnya adalah:
Kita mulai dulu membuat struktur Lewis NaCl dengan mencari tahu atom mana yang bertindak sebagai pelepas elektron dan penangkap elektron.
- NaCl
- MgCl2
- Mg3N2
Kita mulai dulu membuat struktur Lewis NaCl dengan mencari tahu atom mana yang bertindak sebagai pelepas elektron dan penangkap elektron.
Konfigurasi elektron:
Na(11) = 2 8 1
Karena elektron valensi Na adalah 1, maka unsur ini cenderung melepaskan elektron valensinya ini untuk mencapai kestabilan.
Na ⇒ Na+ + e
Ketika melepaskan elektronnya, atom Na akan berubah menjadi di ion positif dengan besar muatan positifnya = jumlah elektron yang dilepaskan (untuk muatan +1, biasanya angka satunya tidak ditulis)
Struktur lewis dari ion Na+ adalah sebagai berikut.
Tidak ada elektron yang dituliskan di sekitar ion Na+ karena elektron tersebut sudah dilepaskan.
Cl (17) = 2 8 7
Jika dilihat dari jumlah elektron valensinya, Cl cenderung untuk menangkap satu buah elektron untuk mencapai kestabilan (dengan 8 e valensi).
Cl + e ⇒ Cl-
Setelah menangkap satu buah elektron, atom Cl akan berubah menjadi ion negatif, Cl-, dengan muatan negatif nya = jumlah elektron yang ditangkap.
Struktur Lewis dari ion Cl- adalah sebagai berikut.
Elektron valensinya berjumlah 8 yang salah satunya berasal dari atom Na.
Untuk menangkap satu buah elektron yang dilepaskan oleh Na hanya membutuhkan satu buah atom Cl. Oleh karena itulah, senyawa ion yang terbentuk dari kedua unsur ini memiliki rumus NaCl.
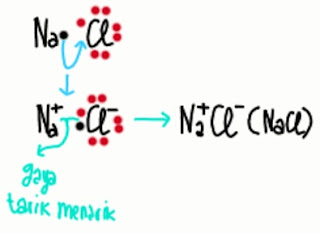
Proses pembentukan NaCl dapat kamu perhatikan pada gambar dibawah ini.
Untuk menulis struktur Lewis dari NaCl, cukup dibuat seperti gambar dibawah ini.
Struktur Lewis MgCl2
Pada senyawa ini, ada satu buah atom magnesium (Mg) dan dua buah atom Cl. Nah, bagaimanakah kira-kira struktur Lewisnya?
Pada senyawa ini, ada satu buah atom magnesium (Mg) dan dua buah atom Cl. Nah, bagaimanakah kira-kira struktur Lewisnya?
Magnesium:
Konfigurasi elektron
- Mg (12) = 2 8 2 ⇒ ev = 2 ⇒ melepaskan dua elektron membentuk ion Mg^2+.
- Cl (16) = 2 8 7 ⇒ ev = 7 ⇒ menangkap satu elektron membentuk ion Cl-
Perhatikan jumlah elektron yang ditangkap dan diterima pada kedua unsur diatas.
Atom Mg dapat melepaskan 2 buah elektron sementara atom Cl hanya dapat menangkap satu elektron. Oleh karena itulah dibutuhkan dua buah atom Cl agar dapat berikatan dengan Mg sehingga rumus senyawa ion ini adalah MgCl2.
Sama seperti NaCl, struktur Lewis dari MgCl2 adalah sebagai berikut.
Bedanya hanya pada angka dua yang menunjukkan jumlah dari atom Cl pada senyawa tersebut.
Kalau jumlah atomnya, biasanya angkanya tidak ditulis.
Nah, mudah bukan!
Dengan dua contoh diatas, tentunya kamu sudah dapat membuat struktur Lewis dari berbagai macam senyawa ion.
Coba deh, kamu tulis dulu bagaimana struktur Lewis dari Mg3N2, lalu cocokkan dengan yang saya buat berikut ini. Oh ya, nomor atom Mg itu adalah 12 dan N = 7.
Struktur Lewis Mg3N2
Konfigurasi elektron
- Mg (12) = 2 8 2 ⇒ ev = 2 ⇒ melepaskan dua elektron membentuk ion Mg^2+
- N (7) = 2 5 ⇒ ev = 5 ⇒ menangkap tiga elektron membentuk ion N^3+.
Nah, bagaimana? Apakah kamu benar? Yeeee, selamat ya.
Nah sekian penjelasan tentang cara menggambar struktur lewis dari senyawa ion seperti NaCl, MgCl2 dan Mg3N2. Semoga penjelasan di atas bermanfaat ya.
Untuk Bab Ikatan Kimia, Bentuk Molekul dan Gaya Antar Molekul, saya sudah buat berbagai macam artikel mulai dari materi, contoh soal dan pembahannya. Jika kamu tertarik, kamu dapat kunjungi link dibawah ini ya:
- Contoh Soal Gaya Antar Molekul dan Pembahasannya
- Materi Gaya Antar Molekul
- Materi Kestabilan Unsur
- Materi Aturan Oktet dan Penyimpangannya
- Contoh Soal Teori Hibridisasi
- Contoh Soal Bentuk Geometri Molekul dengan Teori Domain elektron
- Materi Bentuk molekul dengan teori domain elektron
- Contoh soal Bab Ikatan Kimia Ikatan Kovalen dan Senyawa Kovalen
- Jenis-Jenis Ikatan Kovalen
- Perbedaan Ikatan Ion dan Kovalen Dari Proses Pembentukannya
- Contoh soal bab Ikatan kimia kestabilan unsur dan struktur lewis
- Daftar berbagai macam bentuk molekul senyawa dengan teori domain elektron
- Perbedaan ikatan kovalen polar dan non polar
- Contoh soal tentang struktur lewis
- Struktur Lewis senyawa kovalen





Posting Komentar untuk "Menggambar Struktur Lewis NaCl, MgCl2 dan Mg3N2 (Senyawa Ion)"