Gaya Antar Molekul
Di dalam artikel ini terdapat penjelasan lengkap mengenai gaya antar molekul, disertai gambar pendukung dan kepolaran molekul. Poin-poin yang dijelaskan di dalam artikel ini antara lain:
- Kepolaran Molekul
- Ikatan Hidrogen
- Gaya Van Der Waals dan Jenis - Jenisnya
Gaya Antar Molekul
Kepolaran Molekul
Jika dua unsur yang berbeda keelektronegatifan berikatan, maka akan terjadi perbedaan muatan listrik di kedua atom. Unsur yang lebih elektronegatifan akan bermuatan negatif, karena sifat unsur yang menarik elektron yang dipakai bersama dalam ikatan. Sedankan atom yang lain bermuatan positif.
Contoh :
Molekul HCl
Keelektronegatifan C > H
Akibatbya timbul kitub pada molekul tersebut, yaitu kutub positif dan kutub negatif. Molekul yang mempunyai dua kutub disebut dengan molekul polar. Molekul polar hanya terjadi pada senyawa yang berikatan kovalen.
Kutub postif dan kutub negatif berbeda dengan ion positif dengan ion negatif. Kutub muncul pada molekul yang sama, sementara ion positif dan ion negatifmemrupakan partikel bebas yang tidak saling berikatan.
Kepolaran molekul dwiatom (terdiri dari dua jenis atom) dapat langsung diketahui dari kepolaran ikatannnya. Ikatan yang polar timbul dari perbedaan keelektronegatifan atom atom yang berikatan.
Contoh :
Nilai keelektronegatifan Cl = 3
Perbedaan keelektronegatifan = 3 - 3 = 0
Karena pada molekul  , tidak memiliki perbedaan keelektronegatifan maka ikatan dalam molekul ini bersifat non polar. Elektron yang dipakai bersama berada tepat di kedua atom (tidak ke salah satu atom).
, tidak memiliki perbedaan keelektronegatifan maka ikatan dalam molekul ini bersifat non polar. Elektron yang dipakai bersama berada tepat di kedua atom (tidak ke salah satu atom).
Molekul HCl
Nilai keelektronegatifan H = 2,1 dan Cl = 3
Perbedaan keelektronegatifan = 3 - 2,1 = 0,9
Karena ada perbedaan (cukup besar) keelektronegatifan unsur H dan Cl , maka ikatan yang akan terjadi bersifat polar. Elektron yang dipakai bersama akan lebih tertarik ke arah atom Cl sehingga menjadi kutub negatif molekul dan atom H menjadi kutub positif.
Kepolaran molekul poliatomik (terdiri lebih dari dua atom) diepngaruhi oleh kepolaran ikatan dan sudut ikatannnya. Kepolaran molekul poliatomik dapat diketahui dengan menghitung/ melihat harga momen dipol senyawa dan momen dipol beberapa ikatan
Contoh :
Bentuk molekul = Sudut (dengan sudut ikatan )
Jika kita hitung penjumlahan vektor momen dipol ikatan O - H pada molekul  , hasilnya adalah = 1,64. Artinya ikatan O - H dalam molekul
, hasilnya adalah = 1,64. Artinya ikatan O - H dalam molekul  , momen dipol ikatannya tidak saling meniadakan. Hal ini disebabkan oleh bentuk molekul yang tidak simetri, sehingga molekul
, momen dipol ikatannya tidak saling meniadakan. Hal ini disebabkan oleh bentuk molekul yang tidak simetri, sehingga molekul  bersifat polar.
bersifat polar.
Bentuk molekul = Linier ( sudut ikatan = )
Jika dihitung penjumlahan vektor momen dipol ikatan pada molekul 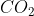 hasilnya adalah 0. Kenapa??? Karena bentuk molekul yang simetri, sehingga momen dipol ikatan saling meniadakan ( yang satu ke arah kiri dan yang lain ke arah kanan). Akibatnya molekul
hasilnya adalah 0. Kenapa??? Karena bentuk molekul yang simetri, sehingga momen dipol ikatan saling meniadakan ( yang satu ke arah kiri dan yang lain ke arah kanan). Akibatnya molekul 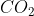 bersifat non polar.
bersifat non polar.
Indikator lain yang dapat digunakan untuk menentukan kepolaran molekul poliatom adalah ada atau tidaknya pasangan elektron bebas. Pasangan elektron bebas dalam suatu molekul akan mempengaruhi bentuk molekul.
Contoh :
Bentuk molekul = tetrahedral
Pasangan elektron bebas = 0
Karena tidak mempunyai pasangan elektron bebas, bentuk molekulnya menjadi simetri. Pada molekul yang simetri, momen dipol ikatannnya saling meniadakan sehingga molekul 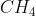 bersifat non polar.
bersifat non polar.
Bentuk molekul = Trigonal piramida
Pasangan elektron bebas = 1
Adanya elektron bebas dalam molekul akan mendorong ikatan N - H sedemikian rupa sehingga sudut ikatannnya berubah dan bentuk molekulnya menjadi tidak simetri lagi. akibatnya momen dipol ikatannya tidak saling meniadakan dan molekul bersifat polar.
Ikatan Hidrogen
Hidrogen adalah atom yang sangat elektropositif, jika berikatan dengan atom yang sangat elektronegatif (F, O, N), pasangan elektron yang dipakai bersama akan tertarik ke arah unsur yang lebih elektronegatif. Akibatnya timbul kutub positif pada atom H dan kutub negatif pada atom F, O dan N. Contoh senyawanya adalah HF,  dan
dan 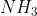 .
.
Jika terdapat sejumlah molekul  (misalnya) dalam gelas kimia, maka hidrogen yang terdapat dalam molekul
(misalnya) dalam gelas kimia, maka hidrogen yang terdapat dalam molekul  yang satu akan dapat membentuk ikatan tambahan dengan oksigen dari molekul
yang satu akan dapat membentuk ikatan tambahan dengan oksigen dari molekul  yang lain. Ikatan tambahan ini adalah ikatan antar molekul yang disebut dengan ikatan hidrogen.
yang lain. Ikatan tambahan ini adalah ikatan antar molekul yang disebut dengan ikatan hidrogen.
Ikatan hidrogen adalah ikatan antara molekul yang mengandung atom hidrogen dan bersifat sangat polar, dimana ada gaya tarik listrik antara atom hidrogen dengan unsur yang lebih elektronegatif, sedangkan kedua atom ini sedang berikatan kovalen dengan atom lain.
Ikatan Hidrogen dalam beberapa molekul :
Ikatan hidrogen termasuk gaya antar molekul yang cukup kuat sehingga mempengaruhi titik didih suatu senyawa. Hal ini menimbulkan penyimpangan titik didih senyawa dalam satu golongan
Contoh senyawa golongan IV A
Normalnya, semakin besar Mr suatu senyawa meka energi yang dibutuhkan untuk mendidihkan senyawa tersebut semakin besar pula. Akibatnya titik didh senyawa semakin tinggi. Keteraturan ini terlihat dari titik didih 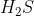 sampai
sampai 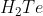 yang meningkat seiring pertambahan Mr senyawa. Tetapi molekul
yang meningkat seiring pertambahan Mr senyawa. Tetapi molekul  yang Mr senyawanya paling kecil, justru memiliki titik didh yang paling besar dalam golongannya. Setelah diteliti, ternyata hal ini disebabkan karena dalam molekul
yang Mr senyawanya paling kecil, justru memiliki titik didh yang paling besar dalam golongannya. Setelah diteliti, ternyata hal ini disebabkan karena dalam molekul  terdapat ikatan hidrogen. Ikatan tambahan ini menyebabkan ebergi yang dibutuhkan untuk mendidihkan air jauh lebih besar dibandingkan dengan senyawa lain dalam golongannnya yang tidak memiliki ikatan hidrogen antar molekulnya, akibatnya titik didh air menjadi meningkat.
terdapat ikatan hidrogen. Ikatan tambahan ini menyebabkan ebergi yang dibutuhkan untuk mendidihkan air jauh lebih besar dibandingkan dengan senyawa lain dalam golongannnya yang tidak memiliki ikatan hidrogen antar molekulnya, akibatnya titik didh air menjadi meningkat.
Penyimpangan ini juga terjadi pada molekul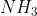 dan HF yang juga memiliki ikatan hidrogen. Berikut disajikan grafik perubahan titik didih senyawa dari golongan IVA, VA, VIA dan VIIA.
dan HF yang juga memiliki ikatan hidrogen. Berikut disajikan grafik perubahan titik didih senyawa dari golongan IVA, VA, VIA dan VIIA.
Gaya Van Der Waals
Banyak bukti yang menunjukkan bahwa adanya gaya tarik antara sesama molekul baik polar - polar, polar - non polar, atau non polar - non polar. Gaya ini sangat lemah dan secara umum disebut dengan gaya Van Der Waals.
Gaya Van Der Waals dapat terjadi antara partikel yang sama atau partikel yang berbeda. Gaya ini sebenarnya timbul akibat sifat kepolaran partikel. Semakin kecil epolaran senyawa maka semakin lemah gaya Van Der Waalsnya.
Ada beberapa jenis gaya Van Der Waals
Gaya ion - dipol = Ion + Molekul Polar
Gaya ini terjadi antara ion dan molekul polar
Contoh :
Gaya ion-dipol cukup kuat dan penting dalam proses pelarutan zat. Ion positif dan ion negatif serta aenyawa ion (terbentuk dari gabungan ion postif dan ion negatif ) dapat larut dalam pelarut polar, misalnya air.
Gaya dipol - dipol = Molekul Polar + Molekul Polar
Gaya antar molekul ini terjadi jika ujung positif salah satu molekul polar ditarik oleh ujung negatif molekul polar lainnya. Ikatan hidrogen termaduk ke dalam gaya dipol dipol.
Gaya ini dapat terjadi antara molekul polar yang sama atau molekul polar yang berbeda. Gaya ini penting dalam prinsip pelarutan, karena senyawa polar hanya akan larut dalam pelarut polar. Hal ini disebabkan karena adanya interaksi kutub kutub senyawa polar.
Gaya Ion - Dipol Terinduksi = Ion /Molekul polar + Molekul Non Polar
Gaya ini terjadi akibat adanya induksi partikel bermuatan (ion atau molekul polar) terhadap molekul netral (molekul non polar) , sehingga molekul netral sesaat menjadi molekul yang mempunyai dipol/ mempunyai kutub.
Contoh :
Ikatan ini relatif lemah karena dipol terinduksi kepolarannya lebih kecl dibandingkan dengan dipol permanen.
Gaya Dipol - Dipol Terinduksi = Molekul Polar + Molekul Non Polar
Gaya ini terjadi antara molekul polar yang menginduksi molekul non polar sehingga sesaat molekul non polar itu bersifat polar. Gaya ini sangat lemah karena prosesnya berlangsung lambat.
Contoh :
Gaya Dipol Terinduksi - Dipol Terinduksi = Non Polar + Non Polar = Gaya London
Pasangan elektron dalam suatu molekul selalu bergerak mengelilingi inti, baik secara bebas mapun terikat. Elektron yang bergerak itu dapat mengimbas molekul tetangganya sehingga menjadi polar sesaat. Molekul yang terinduksi sesaat ini dapat juga menginduksi molekul polar tetangganya, sehingga terjadilah gaya angara dua molekul yang terinduksi. Gaya ni disebut dengan gaya London.
Gaya london sangat dipengaruhi oleh jarak antara molekul, sehingga gaya ini paling besar ada pada molekul molekul dalam kekadaan padat dan cai. Pada molekul yang padat, gaya London akan lebih kuat karena jarak molekul yang sangat rapat.
Gaya london bergantung pada Mr senyawa. Makin besar Mr senyawa maka akan semakin banyak elektron dalam atom dan semakin mudah menginduksi molekul lain sehingga terbentuk dipol.
Source :
Kimia Dasar, Syukri S, FMIPA IKIP Padang
LKS Kimia Kelas 11 SMA
Artikel ini telah diupdate pada tanggal 31-10-2022
Untuk Bab Ikatan Kimia, Bentuk Molekul dan Gaya Antar Molekul, saya sudah buat berbagai macam artikel mulai dari materi, contoh soal dan pembahannya. Jika kamu tertarik, kamu dapat kunjungi link dibawah ini ya:
- Contoh Soal Gaya Antar Molekul dan Pembahasannya
- Materi Kestabilan Unsur
- Materi Aturan Oktet dan Penyimpangannya
- Contoh Soal Teori Hibridisasi
- Contoh Soal Bentuk Geometri Molekul dengan Teori Domain elektron
- Materi Bentuk molekul dengan teori domain elektron
- Contoh soal Bab Ikatan Kimia Ikatan Kovalen dan Senyawa Kovalen
- Jenis-Jenis Ikatan Kovalen
- Perbedaan Ikatan Ion dan Kovalen Dari Proses Pembentukannya
- Contoh soal bab Ikatan kimia kestabilan unsur dan struktur lewis
- Daftar berbagai macam bentuk molekul senyawa dengan teori domain elektron
- Perbedaan ikatan kovalen polar dan non polar
- Contoh soal tentang struktur lewis
- Struktur Lewis senyawa ion
- Struktur Lewis senyawa kovalen












Posting Komentar untuk "Gaya Antar Molekul"