30 Soal Kimia Kelas 12 SMA (Pilihan Ganda) Tentang Sifat Koligatif Larutan Beserta Pembahasannya {UPDATE}
Kompetensi Dasar
Indikator
- Menjelaskan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku larutan, dan tekanan osmosis termasuk sifat koligatif larutan.
- Membandingkan antara sifat koligatif larutan non elektrolit dengan sifat koligatif larutan elektrolit yang konsentrasinya sama berdasarkan data percobaan.
Indikator
- Menghitung konsentrasi suatu larutan (kemolalan dan fraksi mol
- Menjelaskan pengertian sifat koligatif larutan non elektrolit (hukum Roulth) dan larutan elektrolit
- Menjelaskan pengaruh zat terlarut yang sukar menguap terhadap tekanan uap pelarut.
- Menghitung tekanan uap larutan berdasarkan data percobaan.
- Mengamati penurunan titik beku suatu zat cair akibat penambahan zat terlarut melalui percobaan
- Menghitung penurunan titik beku larutan elektrolit dan non elektrolit berdasarkan data percobaan
- Mengamati kenaikan titik didih suatu zat cair akibat penambahan zat terlarut melalui percobaan
- Menghitung kenaikan titik didih larutan elektrolit dan non elektrolit berdasarkan data percobaan
- Menganalisis diagram PT untuk menafsirkan penurunan tekanan uap, penurunan titik beku dan kenaikan titik didih larutan
- Menjelaskan pengertian osmosis dan tekanan osmosis serta terapannya
- Menghitung tekanan osmosis larutan elektrolit dan non elektrolit
- Menganalisis data percobaan untuk membandingkan sifat koligatif larutan elektrolit dan non elektrolit
Pilihlah Jawaban Yang Tepat
Soal 1
Molalitas larutan NaF 12 % massa dalam air adalah . . . . .m (Mr NaF = 42)
A. 2,25
B. 2,50
C. 2,75
D. 3,00
E. 3.25
Pembahasan:
Larutan NaF 12% dalam air mengandung arti bahwa terlarut 12 gram NaF dalam 100 gram larutan. Dengan begitu, kita bisa cari massa pelarut (air) di dalam larutan yaitu sebagai berikut:
Massa Larutan = massa NaF + massa air
Massa air = massa larutan - massa NaF
Massa air = 100 gram - 12 gram
Massa air = 88 gram
Setelah itu, baru kita bisa mencari molalitas larutan NaF tersebut dengan rumus:
m = gr/Mr x 1000/p
Keterangan:
m = molalitas
gr = massa zat terlarut
p = massa pelarut
m = gr/Mr x 1000/p
m = 12/42 x 1000/88
m = 3,25 (pembulatan)
Kunci Jawaban: E
Soal 2
Sebanyak 15 gram zat X dilarutkan dalam 54 gram air akan menghasilkan larutan dengan fraksi mol sebesar . . . . .(Mr X = 75,Mr  = 18).
= 18).
A. 0,0625
B. 0,0725
C. 0,1250
D. 0,1500
E. 0,1625
Pembahasan:
Untuk mencari fraksi mol (Xt), maka kita perlu mencari mol masing-masing komponen larutan yaitu mol zat X dan mol air.
mol zat X = nt = gr/Mr = 15 gram/75 gr/mol = 0,2 mol
mol air = np = gr/Mr = 54/18 = 3 mol
Fraksi mole terlarut (Xt) dicari dengan menggunakan rumus:
Xt = nt(nt + np)
Xt = 0.2/(0,2 + 3)
Xt = 0,2/3,2
Xt = 0,0625
Kunci Jawaban: A
Soal 3
Molalitas larutan metanol yang mempunyai 32 % massa dalam air adalah . . . .m(Ar H = 1, C = 12, O = 16).
A. 10,7
B. 11,7
C. 12,7
D. 13,7
E. 14,7
Pembahasan:
Metanol memiliki rumus kimia CH3OH. Mr metanol = 1 x 12 + 4 x 1 + 1 x 16 = 32 gr/mol
Seperti yang sudah dijelaskan pada soal pertama, larutan metanol 32% mengandung arti bahwa terdapat 32 gram metanol dalam 100 gram larutan. Maka, massa air dalam larutan tersebut adalah:
= massa larutan - massa metanol
= 100 gram - 32 gram
= 68 gram
Molalitas dapat dicari menggunakan rumus:
m = gr/Mr x 1000/p
m = 32/32 x 1000/68
m = 14,7 molal
Kunci Jawaban: E
Soal 4
Fraksi mol zat terlarut dan pelarut jika ke dalam 180 gram air dilarutkan 12 gram urea secara berturut utrut adalah . . . . (Mr urea = 60 dan air = 18)
A. 0,01 dan 0,02
B. 0,02 dan 5
C. 0,01 dan 0,98
D. 0,02 dan 0,98
E. 0,02 dan 0,99
Pembahasan:
Cara menjawab soal ini mirip dengan soal nomor 2 ya. Langkah pertama, kita akan cari terlebih dahulu mol masing-masing komponen larutan.
mol urea = nt = gr/Mr = 12/60 = 0,2 mol
mol air = np = gr/Mr = 180/18 = 10 mol
Maka:
Fraksi mol terlarut = Xt
= nt/(nt + np)
= 0.2/(0.2 + 10)
= 0,2/10,2
= 0,02 (pembulatan)
Sedangkan fraksi mole pelarut = Xp dapat dicari dengan rumus:
Xp = 1 - Xt
Xp = 1 - 0,02
Xp = 0,98
Catatan:
Xt + Xp = 1. Jika jumlah Xt + Xp yang kalian dapatkan lebih dari 1, itu menunjukkan ada yang salah dengan perhitungan yang kalian lakukan.
Kunci Jawaban: D
Soal 5
Suatu larutan etanol (C2H5OH) memiliki fraksi mol sebesar 0,5. Konsentrasi larutan etanol tersebut jika dinyatakan dalam persen massa adalah.......(diketahui Ar C = 12, H = 1 dan O = 16)
A. 84 %
B. 72 %
C. 68%
D. 56%
E. 44%
Pembahasan:
Dari soal diketahui bahwa fraksi mol etanol = Xt = 0,5. Dari rumus fraksi mol terlarut, kita bisa dapatkan suatu persamaan seperti dibawah ini:
Xt = nt/(nt + np)
0,5 = nt/(nt + np)
0,5 nt + 0,5 np = nt
0,5 np = 0,5 nt
atau
np = nt
Dari persamaan diatas diketahui bahwa mol pelarut = mole zat terlaurt. Jika kita misalkan mol zat terlarut = nt = 1 mol, maka mol pelarut = np = juga 1 mol.
Massa zat terlaur = massa etanol = mol x Mr = 1 mol x 46 gr/mol = 46 gram
Massa pelarut = massa air = mol x Mr = 1 mol x 18 gr/mol = 18 gram
Massa larutan = massa etanol + massa air = 46 + 18 = 64 gram
Maka, persentase etanol dalam larutan tersebut adalah:
= (massa etanol/massa larutan) x 100%
= (46/64) x 100%
= 72% (pembulatan)
Kunci Jawaban: B
Soal 6
Larutan berikut yang memiliki penurunan titik beku terbesar adalah . . . . .
A. Glukosa 0,05 m
B. Glukosa 0,10 m
C. Sukrosa 0,10 m
D. Sukrosa 0,15 m
E. Urea 0,20 m
Pembahasan:
Rumus yang kita gunakan untuk mencari penurunan titik berku larutan adalah:
ΔTf = m x Kf
Dari rumus diatas dapat diketahui bahw besarnya penurunan titik beku larutan berbanding lurus dengan molalitas larutannya. Itu artinya, larutan yang penurunan titik bekunya paling besar adalah larutan yang molalitasnya paling besar pula yaitu larutan urea 0,2 m.
Kunci Jawaban: E
Soal 7
Penurunan titik beku molal bergantung pada . . . . .
A. Jenis pelarut
B. Titik didh Pelarut
C. Molaritas larutan
D. Molalitas larutan
E. Jenis zat terlarut
Pembahasan:
Penurunan titik beku adalah salah satu sifat koligatif larutan. Kamu tentu sudah mengetahui bahwa sifat koligatif larutan hanya bergantung pada jumlah partikel zat terlarut di dalam larutan. Untuk penurunan titik beku, jumlah partikel zat terlarut di dalam larutan dinyatakan dalam satuan molalitas.
Kunci Jawaban: D
Soal 8
Jika diketahui derajat ionisasi HNO3 dalam larutan = 1 dan Kb air =  kenaikan titik didih larutan 12,6 gram HNO3 (Mr = 63) dalam 250 gram air sebesar . . . . .
kenaikan titik didih larutan 12,6 gram HNO3 (Mr = 63) dalam 250 gram air sebesar . . . . .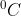
A. 0,13
B. 0,39
C. 0,52
D. 0,72
E. 0,83
Pembahasan:
HNO3 adalah asam kuat (elektrolit). Untuk menentukan besar kenaikan titik didih larutan HNO3, kita harus cari terlebih dahulu faktor Vant Hoff-nya (i).
Untuk senyawa elektrolit kuat (mengion sempurna di dalam air), maka harga faktor Vant Hoff-nya = jumlah ion yang dihasilkan oleh senyawa tersebut ketika mengalami ionisasi.
Reaksi ionisasi HNO3 dalam air:
HNO3(aq) ==> H+(aq) + NO3-(aq)
Jumlah ion = 2
i = 2
Setelah itu barulah besar kenaikan titik didih larutan elektrolit dapat dihitung menggunakan rumus:
ΔTb = m x Kb x i
ΔTb = gr/Mr x 1000/p x Kb x i
ΔTb = 12,6/63 x 1000/250 x 0,52 x 2
ΔTb = 0,83 degC
Kunci Jawaban : E
Soal 9
Tekanan osmotik larutan MSO4 0,1 M (derajat ionisasi = 0,2) pada suhu  (R = 0,082) adalah . . . . .atm
(R = 0,082) adalah . . . . .atm
A. 2,95
B. 4,34
C. 6,00
D. 7,25
E. 8,45
Pembahasan:
Pada soal, diketahui data derajat ionisasi. Hal itu menandakan bahwa MSO4 adalah elektrolit lemah. Kita harus cari harga faktor Vant Hoff-nya terlebih dahulu.
Reaksi ionisasi MSO4 dalam air:
MSO4(aq) <=> M2+(aq) + SO4^2-(aq)
Jumlah ion = n = 2
i = 1 + (n-1)α
i = 1 + (2 - 1)0,2
i = 1,2
Setelah itu, baru tekanan osmotik larutan bisa dicari menggunakan rumus:
π = MRTi
π = 0,1 M x 0,082 L atm/mol K x 300 K x 1,2
π = 2,95 atm
Kunci Jawaban: A
Soal 10
Perhatikan diagram P - T!
A. A - E
B. B - A
C. C - D
D. B - F
E. D - E
Pembahasan:
Pada diagram P - T diatas, yang diberi garis putus-putus adalah kurva untuk larutan dan yang tebal adalah kurva untuk air. Garis yang menunjukkan proses membekunya larutan adalah garis AE.
Kunci Jawaban: A
Soal 11
Perhatikan gambar beberapa larutan di bawah ini!
Jika volume larutan semua larutan tersebut dianggap sama, larutan ynag mempunyai tekanan uap paling rendah ditunjukkan oleh nomor . . . . .
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan:
Penurunan tekanan uap merupakan salah satu sifat koligatif larutan yang nilainya bergantung pada jumlah zat terlarut. Penurunan tekanan uap paling besar terdapat pada larutan yang jumlah zat terlarutnya paling banyak. Semakin besar penurunan tekanan uap suatu larutan, maka semakin rendah pula tekanan uap larutan tersebut.
Pada soal diatas, yang diminta adalah larutan mana yang mempunyai tekanan uap paling rendah. Jawabannya tentu adalah larutan dengan jumlah zat terlarut paling banyak yaitu larutan nomor 2.
Kunci Jawaban: B
Soal 12
Ke dalam 500 gram air dilarutkan 4,38 gram senyawa Al2(SO4)3 . Jika Kb air =  ,titik didih larutan tersebut adalah . . . . .
,titik didih larutan tersebut adalah . . . . .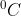 (Ar Al = 27, S = 32, O = 18)
(Ar Al = 27, S = 32, O = 18)
A. 100,025
B. 100,035
C. 100,052
D. 100,105
E. 100,150
Pembahasan:
Pada soal diatas, tidak diketahui data derajat ionisasi. Itu artinya senyawa Al2(SO4)3 merupakan senyawa elektrolit kuat yang mengion sempurna di dalam air.
Reaksi ionisasi Al2(SO4)3:
Al2(SO4)3 ==> 2Al^3+ + 3SO4^2-
Jumlah ion = 5
Karena merupakan elektrolit kuat maka harga faktor Vant Hoff-nya = i = jumlah ion = 5.
Kenaikan titik didih:
ΔTb = m x Kb x i
ΔTb = gr/Mr x 1000/p x Kb x i
ΔTb = 4,38/438 x 1000/500 x 0,52 x 5
ΔTb = 0,052 degC
Titik didih larutan
= titik didih air murni + ΔTb
= 100 degC + 0,052 degC
= 10,052 degC
Kunci Jawaban: C
Soal 13
Sebanyak 4 gram suatu senyawa elektrolit biner (Mr = 80) dilarutkan dalam 400 mL larutan. Jika diketahui senyawa elektrolit tersebut terionisasi sebanyak 10 % pada suhu  , Larutan tersebut mempunyai tekanan osmotik sebesar . . . .atm.
, Larutan tersebut mempunyai tekanan osmotik sebesar . . . .atm.
(R = 0,082 L atm /mol K)
A. 1,5
B. 2,8
C. 3,4
D. 4,7
E. 5,6
Pembahasan:
Senyawa elektrolit biner menunjukkan bahwa senyawa tersebut di dalam air terionisasi menghasilkan dua buah ion (n = 2). Karena ada data derajat ionisasinya, maka senyawa elektrolit ini termasuk ke dalam elektrolit lemah. Oleh karena itu, kita cari faktor Vant Hoff-nya terlebih dahulu.
i = 1 + (n - 1)α
i = 1 + (2 - 1)0,1
i = 1,1
Tekanan osmotik larutan sebesar:
π = MRTi
π = gr/Mr x 1000/V x R x T x i
π = 4/80 x 1000/400 x 0,082 x 300 x 1,1
π = 3,4 atm
Kunci Jawaban: C
Soal 14
Dalam 200 gram air terlarut 12 gram zat Y (non elektrolit). Larutan tersebut membeku pada suhu - 2,78 ℃. Jika Kf air = , Mr zat Y tersebut adalah . . . . .
, Mr zat Y tersebut adalah . . . . .
A. 30
B. 40
C. 46
D. 60
E. 80
Pembahasan:
Zat Y adalah senyawa non elektrolit. Mr bisa dicari dari rumus penurunan titik beku.
ΔTf = Tf air - Tf larutan
ΔTf = 0 ℃ - (-2,79 ℃)
ΔTf = 2,79 degC
ΔTf = m x Kf
ΔTf = (gr x 1000 x Kf)/(Mr x p)
2,79 = (12 x 1000 x 1,86)/(Mr x 200)
2,79 x 200Mr = 22.320
Mr = 40
Kunci Jawaban: B
Soal 15
Berikut ini dalam kehidupan sehari hari
- Membuat cairan infus
- Mencairkan salju di jalan raya
Kedua contoh soal diatas berhubungan dengan sifat koligatif larutan secara berturut turut . . . . .
A. Penurunan tekanan uap dan tekanan osmotik
B. Tekanan osmotik dan penurunan titik beku
C. Kenaikan titik didih dan penurunan titik beku
D. Penurunan titik beku dan osmotik balik
E. Penurunan titik beku dan kenaikan titik didih
Pembahasan:
Membuat cairan infus merupakan penerapan dari sifat koligatif tekanan osmotik. Cairan infus yang akan dimasukkan ke dalam tubuh haruslah isotonik dengan cairan tubuh.
Sedangkan, mecairkan salju di jalan raya adalah contoh penerapan sifat koligatif larutan penurunan titik beku. Ketika garam disebar pada tumpukan es yang ada di jalan raya, maka terjadi penurunan titik beku. Air yang awalnya membeku menjadi es pada suhu 0 degC, setelah ditambah garam akan mengalami penurunan titik beku sehingga akan mencair.
Kunci Jawaban: B
Soal 16
Pada suhu tertentu, larutan 3 gram urea (Mr = 60) dalam 100 mL air isotonik dengan larutan 5,5 gram X (non elektrolit) dalam 250 mL air. Zat X tersebut memiliki massa molekul relatif . . . . .
A. 19
B. 29
C. 36
D. 44
E. 64
Pembahasan:
Dua larutan yang isotonik mengandung arti bahwa tekanan osmotik kedua larutan adalah sama.
π glukosa = π zat X
(MRT) glukosa = (MRT) zat X
Nilai R dan T kedua larutan adalah sama, sehingga bisa kita coret. Rumus diatas akan menjadi:
M glukosa = M zat X
(gr/Mr x 1000/V) glukosa = (gr/Mr x 1000/V) zat X
(3/60 x 1000/100) glukosa = (5,5/Mr x 1000/250) zat X
0,5 = 22/Mr zat X
Mr zat X = 22/0,5
Mr zat X = 44
Kunci Jawaban: D
Soal 17
Larutan 1,54 gram CCl4 (Mr = 154) dalam 400 gram kloroform ( ) memiliki titik didih 0,96 ℃ lebih tinggi dari titik didih kloroform murni. Tetapan titik didih molal kloroform adalah . . . . .
) memiliki titik didih 0,96 ℃ lebih tinggi dari titik didih kloroform murni. Tetapan titik didih molal kloroform adalah . . . . .
A. 0,48
B. 1,84
C. 2,48
D. 3,84
E. 5,44
Pembahasan:
Tetapan titik didih molal kloroform bisa kita cari dari rumus kenaikan titik didih larutan sebagai berikut:
ΔTb = m x Kb
Kb = ΔTb/m
Kb = 0,96/(gr/Mr x 1000/p)
Kb = 0.96/(15,4/154 x 1000/400)
Kb = 0,96/0,25
Kb kloroform = 3,84 ℃ Kg/mol
Kunci Jawaban: D
Soal 18
Suatu larutan gula (Mr = 342) dalam 2 kg air (Kb = 0,52) ternyata mendidih pada suhu 100,13 ℃. Massa gula yang dilarutkan adalah . . . . .gram.
A. 60
B. 112
C. 134
D. 157
E. 171
Pembahasan:
ΔTb = Tb larutan - Tb air murni
ΔTb = 100,13 - 100
ΔTb = 0,13 ℃
ΔTb = m x Kb
m = ΔTb/Kb
m = 0,13/0,52
m = 0,25
gr/Mr x 1000/p = 0,25
gr/342 x 1000/2000 = 0,25
gr = 0,25 x 342 x 2
gr = 171 gram
Kunci Jawaban: E
Soal 19
Massa molekul relatif zat A (non elektrolit) jika 4,3 gram zat tersebut yang larut dalam 20 gram air membeku pada suhu 101,3 degC adalah.......(Kb air = 0,52)
A. 86
B. 118
C. 223
D. 277
E. 336
Pembahasan:
Dari data titik didih larutan dapat diketahui besar kenaikan titik didih larutan yaitu 1,3 degC. Dari rumus mencari kenaikan titik didih, kita bisa cari berapa Mr zat A tersebut.
ΔTb = m x Kb
m = ΔTb/Kb
m = 1,3/0,52
gr/Mr x 1000/p = 2,5
4,3/Mr x 1000/20 = 2,5
4,3 x 50 = 2,5 Mr
Mr = 86 gr/mol
Kunci Jawaban: A
Soal 20
Sebanyak 8,6 gram Be(OH)2 dilarutkan ke dalam 250 gram air. Larutan tersebut membeku pada suhu - 2,232 degC. Jika Ar : Be = 9, O = 16, H = 1, dan Kb air = 1,6 degC/mol, derajat ionisasi basa tersebut sebesar . . . . .%
A. 85
B. 75
C. 65
D. 55
E. 25
Pembahasan:
Reaksi ionisasi Be(OH)2
Be(OH)2 <==> Be^2+ + 2OH-
Jumlah ion = n = 3
Karena Be(OH)2 adalah elektrolit lemah, maka kita perlu mencari harga faktor Vant Hoff-nya melalui rumus penurunan titik beku dibawah ini.
ΔTf = m x Kf x i
i = ΔTf/(m x kf)
i = 2,232/(gr/Mr x 1000/p x Kf)
i = 2,232/(8,6/43 x 1000/250 x 1,86)
i = 2,232/1,488
i = 1,5
i = 1 + (n-1)α
1,5 = 1 + (3 - 1)α
0,5 = 2α
α = 0,25 atau 25%
Kunci Jawaban: E
Soal 21
Sebanyak 0,5 mol suatu senyawa non elektrolit dilarutkan ke dalam 250 gram air, mendidih pada suhu 101,04 degC. Untuk NaCl, agar mendidih pada suhu yang sama dengan larutan non elektrolit tersebut, dalam 200 gram air dilarutkan NaCl sebanyak sebanyak . . . . mol (Kb air = 0,52)
A. 1,00
B. 0,50
C. 0,20
D. 0,05
E. 0,10
Pembahasan:
Pada soal diketahui bahwa titik didih suatu larutan non elektrolit sama dengan titik didih NaCl. Itu artinya, besar kenaikan titik didih kedua larutan juga sama karena kedua larutan sama-sama dilarutkan ke dalam air.
Titik didih larutan non elektrolit dapat dicari menggunakan rumus:
ΔTb = gr/Mr x 1000/p x Kb (gr/Mr = mol)
ΔTb = 0,5 mol x 1000/250 x 0,52
ΔTb = 1,04 degC
ΔTb larutan nonelektrolit = ΔTb NaCl
Karena NaCl adalah senyawa elektrolit kuat yang mengion didalam air menghasilkan dua buah ion, maka harga faktor Vant Hoff larutan NaCl ini adalah 2.
ΔTb NaCl = gr/Mr x 1000/p x Kb x i
1,04 = mol NaCl x 1000/200 x 0,52 x 2
mol NaCl = 1,04/5,2
mol NaCl = 0,2 mol
Kunci Jawaban: C
Soal 22
Tekanan uap air jenuh pada suhu kamar adalah 30 mmHg dan fraksi mol zat X dalam suatu larutan adalah 0,025. Pada suhu tersebut, tekanan uap larutan X adalah . . . . .mmHg.
A. 0,75
B. 29,25
C. 30,00
D. 30,75
E. 31,00
Pembahasan:
Soal ini sangat mudah untuk dijawab karena semua yang dibutuhkan untuk mencari tekanan uap larutan sudah diketahui pada soal.
Tekanan uap jenuh air pada suhu kamar = P^0 = 30 mmHg
Fraksi mol zat X = Xt = 0,025
Penurunan tekanan uap jenuh larutan (ΔP)
= Xt x P0
= 0,025 x 30 mmHg
= 0,75 mmHg
Tekanan uap larutan
= P0 - ΔP
= 30 mmHg - 0,75 mmHg
= 29,25 mmHg
Kunci Jawaban: B
Soal 23
Sebanyak 17,1 gram sukrosa (C12H22O11) dimasukkan ke dalam 500 gram air. Jika kalor beku molal air, Kf =  , titik beku larutan tersebut adalah . . . . .
, titik beku larutan tersebut adalah . . . . .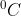 (Ar C = 12, H = 1, O =16)
(Ar C = 12, H = 1, O =16)
A. - 0,19
B. - 0,36
C. - 1,9
D. - 3,6
E. - 7,2
Pembahasan:
ΔTf = m x Kf
ΔTf = gr/Mr x 1000/p x Kf
ΔTf = 17,1/342 x 1000/500 x 1,86
ΔTf = 0,19 deC
Titik beku larutan = titik beku air - penurnan titik beku = 0 - 0,19 = - 0,19
Kunci Jawaban: A
Soal 24
Berikut ini jumlah pertikel zat terlarut yang terdapat dalam 2 mol pelarut dalam ruang tertutup.
Berdasarkan gambar tersebut, titik didih larutan yang paling besar terdapat pada larutan nomor . . . . .
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan:
Kenaikan titik didih larutan dipengaruhi oleh jumlah zat terlarut yang terdapat di dalam larutan. Semakin banyak zat terlarut di dalam larutan maka semakin tinggi pula kenaikan titik didihnya. artinya, titik didih larutan paling tinggi ada pada larutan yang jumlah partikel zat terlarutnya paling banyak. Pada gambar diatas, larutan yang titik didihnya paling besar ditunjukkan oleh gambar 1.
Kunci Jawaban: A
Soal 25
Tabel berikut menunjukkan data sejumlah zat telarut yang dilarutkan dalam air.
Larutan yang memiliki titik beku paling rendah adalah.........
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan:
Sama, seperti sifat koligatif lainnya, penurnan titik beku juga dipengaruhi oleh jumlah partikel zat terlarut didalam larutan. Larutan yang titik bekunya paling rendah adalah larutan yang jumlah zat terlarutnya paling banyak.
Pada tabel diatas, ada dua data yang diberikan, yaitu jumlah zat terlarut (mol) dan massa pelarut. Dari rumus penurunan titik beku berikut.
ΔTf = gr/Mr x 1000/p x Kf
Dapat diketahui bahwa besarnya penurunan titik beku larutan berbanding lurus dengan mol (gr/Mr), tetapi berbanding terbalik dengan massa pelarut (p).
Oleh karena itu, larutan yang punya titik beku paling rendah adalah larutan yang mol zat terlarutnya paling banyak, tetapi volume pelarutnya paling kecil. Pada tabel diatas, yang memenuhi kriteria ini adalah larutan nomor 1.
Kunci Jawaban: A
Soal 26
Masing-masing sebanyak 6 gram urea (Mr = 60) dan glukosa (Mr = 180) dilarutkan ke dalam 100 gram air. Jika diketahui Kb air = 0,5 degC kg/mol, maka besar kenaikan titik didih larutan yang terbentuk adalah........
A. 0,52
B. 1,04
C. 1,56
D. 2,08
E. 2,62
Pembahasan:
Urea dan glukosa tergolong senyawa non elektrolit. Rumus yang kita gunakan untuk mencari besar kenaikan titik didih suatu larutan non elektrolit adalah:
ΔTb = gr/Mr x 1000/p x Kb
Nah, gr/Mr adalah mol zat terlarut. Karena larutan pada soal ini dibuat dari dua jenis zat terlarut yaitu urea dan glukosa, maka mol zat terlarutnya adalah total dari mol urea + mol glukosa. Sehingga rumus diatas menjadi:
ΔTb = (mol urea + mol glukosa) x 1000/p x Kb
ΔTb = (6/60 + 6/180) x 1000/100 x 0,5
ΔTb = (0,1 + 0,03) x 10 x 0,5
ΔTb = 0,52 ℃
Kunci Jawaban: A
Soal 27
Perhatikan beberapa contoh penerapan sifat koligatif larutan di bawah ini.
1. Untuk membuat cairan pendingin pada es putar
2. Zat anti beku radiator mobil
3. Membasmi hama keong emas
4. Obat tetes mata
5. Mencairkan salju di jalan raya
Pemanfaatan sifat koligatif larutan tekanan osmotik ditunjukkan oleh nomor
A. 1, 2 dan 3
B. 1, 2 dan 4
C. 2, 3 dan 4
D. 3 dan 4 saja
C. 4 dan 5 saja
Pembahasan:
Pernyataan nomor 1, 2 dan 5 adalah contoh penerapan sifat koligatif larutan penurunan titik beku yang dapat dijumpai dalam kehidupan sehari-hari. Sedangkan pernyatan 3 dan 4 itulah contoh penerapan sifat koligatif larutan tekanan osmotik.
Kunci Jawaban: D
Soal 28
Dikeathui beberapa larutan berikut.
- NaOH 1 M
- CaCl2 2 M
- Urea 2 M
- KBr 3 M
Berdasarkan data diatas, pada suhu yang sama larutan yang mempunyai mempunyai tekanan osmotik yang sama ditunjukkan oleh nomor . . . . .
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan:
Diantara larutan diatas, urea bukan termasuk elektrolit kuat. sehingga tentunya akan memiliki tekanan osmotik yang berbeda dengan ketiga larutan lain yang merupakan senyawa elektrolit kuat.
Untuk menghitung tekanan osmotik larutan elektrolit kuat, rumus yang digunakan adalah:
π = MRTi
Nilai R dan T ketiga larutan elektrolit kuat diatas adalah sama sehingga sekarang yang mempengaruhi besarnya nilai tekanan osmotik adalah konsentrasi (M) dan i (faktor Vant Hoff).
Larutan yang hasil kali M dan i sama akan memiliki tekanan osmotik paling yang sama pula.
Larutan NaOH 1 M
NaOH ==> Na+ + Cl-
Jumlah ion = i = 2
Hasil kali M x i = 1 x 2 = 2
Larutan CaCl2 2 M
CaCl2 ==> Ca^2+ + 2Cl-
Jumlah ion = i = 3
Hasil kali M x i = 2 x 3 = 6
Larutan KBr 3 M
KBr ==> K+ + Br-
Jumlah ion = i = 2
Hasil kali M x i = 3 x 2 = 6
Ternyata, hasil M x i larutan CaCl2 2M = larutan KBr 3 M. Maka kedua larutan ini akan memiliki tekanan osmotik yang sama.
Kunci Jawaban: D
Soal 29
Besar penurunan titik beku larutan non elektrolit akan sama dengan Kf pada saat........
A. Konsentrasi molar larutan = 1 M
B. Suhu larutan = 300 K
C. Tekanan uap jenuh air = 30 mmHg
D. Konsentrasi molal larutan = 1 m
E. Jumlah partikel zat terlarut di dalam larutan = 1 mol
Pembahasan:
Penurunan titik beku larutan akan sama dengan Kf saat konsentrasi molal larutan = 1 m.
ΔTf = m x Kf
Jika m = 1 m, maka:
ΔTf = 1 x Kf = Kf
Kunci Jawaban: D
Soal 30
Tekanan osmotik larutan garam 1 molar lebih besar daripada tekanan osmotik larutan gula 1 molar. Hal ini disebabkan . . . .
A. Jumlah atom dalam larutan garam lebih sedikit daripada larutan gula.
B. Kedua larutan mempunyai harga molaritas yang sama
C. Garam merupakan larutan nonelektrolit
D. Mr garam lebih kecil daripada Mr gula
E. Garam merupakan larutan elektrolit
Pembahasan:
Tekanan osmotik larutan garam 1 M akan lebih besar dibandingkan tekanan osmotik larutan gula 1 M. Hal ini disebabkan karena garam adalah senyawa elektrolit yang dapat mengion di dalam air, sementara gula tidak bisa. Ionisasi menyebabkan jumlah partikel zat terlarut di dalam larutan garam lebih banyak dibandingkan larutan gula. Oleh sebab itulah, tekanan osmotik larutan garam 1 M lebih besar dari tekanan osmotik larutan gula 1 M.
Kunci Jawaban: E
Nah, itulah 30 buah contoh soal kimia dalam bentuk pilihan ganda untuk ab sifat koligatif larutan beserta pembahasannya yang dapat saya bagikan pada artikel kali ini. Semoga ada manfaatnya bagi kamu yang telah berkunjung ke blog ini.




Posting Komentar untuk "30 Soal Kimia Kelas 12 SMA (Pilihan Ganda) Tentang Sifat Koligatif Larutan Beserta Pembahasannya {UPDATE}"