Teori Asam Basa Lewis
Dalam artikel ini kamu dapat menemukan informasi tentang pengertian, contoh dan kelebihan teori asam-basa Lewis.
Asam dan basa adalah zat yang penting dalam ilmu kimia. Salah satu teori yang paling banyak penggunaannya dalam ilmu kimia adalah teori asam basa Lewis yang memperluas pengertian asam basa yang dikemukakan oleh Bronsted - Lowry.
Teori asam basa Bronsted - Lowry telah digunakan luas dalam konsep asam basa di ilmu kimia. Tetapi bagaimanapun, teori Bronsted - Lowry masih bersifat membatasi dan focus pada pengertian bahwa asam dan basa berkaitan dengan donor atau akseptor proton saja. Kadang-kadang kita temukan kondisi dimana teori ini tidak dapat digunakan terutama untuk zat yang berwujud padat dan gas.
Untuk mengatasi kelemahan ini, pada tahun 1923, G.N Lewis dari Universitas California, Berkeley, mengajukan teori untuk mendeskripsikan asam dan basa.
Perhatikan gambar berikut:
Untuk mengatasi kelemahan ini, pada tahun 1923, G.N Lewis dari Universitas California, Berkeley, mengajukan teori untuk mendeskripsikan asam dan basa.
Pengertian Asam Dan Basa Menurut Teori Lewis
Berikut ini adalah pengertian asam dan basa menurut teori Lewis :- Asam adalah spesi yang menerima pasangan elektron bebas (non ikatan) atau akseptor pasangan elektron non ikatan.
- Basa adalah spesi yang mendonorkan pasangan elektron bebas atau donor pasangan elektron non ikatan.
Konsep asam dan basa menurut teori Lewis berkaitan dengan serah terima (donor-akseptor) pasangan elektron bebas antar dua spesi. Berbeda dengan teori Bronsted-Lowry yang bertumpu pada serah terima proton.
Sumber : Chem.libretexs.org.
Gambar diatas menerangkan bahwa A adalah asam lewis karena menerima pasangan elektron dari B yang bersifat basa. Ikatan yang akan terjadi adalah kovalen koordinasi dimana A (asam) bertugas menyediakan orbital kosong dan B yang akan menyediakan pasangan elektron bebas.
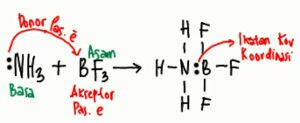
Contoh reaksi asam-basa Lewis = reaksi antara NH3 dan BF3. Struktur dari kedua senyawa ini digambarkan sebagai berikut.
..
H - N - H
|
H
F - B - F
|
F
NH3 adalah spesi yang memiliki pasangan elektron bebas. NH3 dapat bertindak sebagai basa Lewis yaitu dengan mendonorkan pasangan elektron bebasnya kepada BF3.
Agar reaksi dapat terjadi, BF3 harus menyediakan satu orbital kosong sebagai tempat bagi pasangan elektron bebas yang didonorkan oleh NH3.
Mari kita lihat apakah atom B pada BF3 memiliki orbital kosong atau tidak.
Atom B (5) memiliki konfigurasi elektron sebagai berikut:
B = 1s^2 2s^ 2p^1
Diagram orbital terakhir dari atom P adalah:
Karena ada tiga F yang akan berikatan dengan B pada BF3 (ikatan antara B dan F adalah kovalen tunggal), maka satu elektron pada orbital 2s di pindahkan ke orbital 2p seperti gambar dibawah ini.
Nah, dari gambar diatas dapat kamu lihat bahwa atom B pada BF3 punya satu orbital kosong yang dapat diisi oleh pasangan elektron bebas dari NH3.
Maka dari itu, reaksi antara NH3 dan BF3 adalah reaksi asam-basa menurut teori Lewis dengan:
- NH3 = donor pasangan elektron = basa
- BF3 = akseptor pasangan elektron = asam
Contoh Soal
Dengan menggunakan teori asam basa Lewis, tunjukan bahwa reaksi berikut merupakan reaksi asam basa.
H2O + H+ ==> H3O+
Pembahasan:
H2O memiliki struktur sebagai berikut dengan 2 buah pasangan elektron bebas.
..
H - O - H
..
Sedangkan H+ tidak memiliki elektron sama sekali karena terbentuk ketika atom hidrogen melepaskan satu-satunya elektron yang dimilikinya. Oleh karena itu H+ punya satu orbital kosong.
Reaksi yang terjadi antara H2O dengan H+ membentuk H3O+ adalah sebagai berikut.
Asam Lewis
Spesi yang dapat bertindak sebagai asam Lewis harus memiliki ciri-ciri sebagai berikut.
- Asam lewis adalah zat yang menerima pasangan elektron.
- Harus punya orbital kosong.
- Asam lewis adalah zat yang elektrofilik atau suka terhadap elektron.
- Ketika berikatan dengan basa, maka asam Lewis akan meyediakan orbital kosong dengan energi terendah (LUMO) untuk berikatan.
Berikut beberapa contoh zat yang. dapat bertindak sebagai asam lewis.
- Semua kation adalah asam lewis karena dapat dengan mudah menagkap elektron seperti Cu2+, Fe2+, Fe3+ dan lain lain.
- Sebuah atom, ion atau molekul yang tidak lengkap oktetnya dapat betindak sebagai asam lewis seperti BF3, AlF3.
- Molekul dimana atom pusatnya memiliki lebih dari 8 elektron dulut terluarnya bisa menerima elektron lagi dan dapat bersifat sebagai asam lewis seperti SiBr4, SiF4
- Molekul yang mepunyai 2 buah ikatan rangkap dua diantara sebuah atom dapat bertndak sebagai asam lewis. Contoh CO2, SO2 dan lain lain.
Baca Juga: Teori Asam Basa Arrhenius
Basa Lewis
Berikut adalah ciri-ciri spesi yang dapat bertindak sebagai basa Lewis:
- Kebalikan dari asam lewis, basanya adalah spesi yang mendonorkan proton.
- Harus memiliki pasangan elektron bebas.
- Basa lewis adalah nukleofilik yang mudah mendonorkan pasangan elektron bebasnya ke spesi yang bermuatan positif.
- Ketika berikatan dengan asam akan menggunakan orbital molekul dengan tingkat energi tertinggi (HOMO)
Contoh basa Lewis:
Ion atau molekul bebas yang memiliki pasangan elektron bebas bisa menjadi basa Lewis. Beberapa anion berikut bisa memberikan elektronnya kepada asam seperti OH-, CN-, CH3COO-, NH3, H2O, CO dan lain lain.
Orbital HOMO pada basa lewis akan berinteraksi dengan orbital LUMO dari asam lewis untuk mencitakan ikatan molekul dalam bentuk kovalen koordinasi.
Sumber :Chem.libretexs.org
Kelebihan Teori Asam-Basa Lewis
Salah satu kelebihan dari asam basa Lewis adalah bisa menjelaskan sifat asam basa pada molekul atau ion kompleks dimana teori Bronsted Lowry tidak dapat menjelaskannya.
Ion kompleks terdiri dari atom pusat yaitu ion logam yang bermuatan positif, dan Ligand yaitu molekul atau ion yang memiliki pasangan elektron. Ketika membentuk ion kompleks, maka ligand akan mentranfer pasangan elektronnya ke atom pusat.
Sumber :Chem.libretexs.org
Berdasarkan teori asam basa lewis maka atom pusat adalah asam sedangkan ligand nya adalah basa.
Artikel ini termasuk dalam seri artikel Bab Larutan Asam dan Basa. Kamu dapat mengunjungi artikel lain tentang bab ini melalui daftar link berikut:
- Asam Basa Kuat
- Asam Basa Lemah
- pOH dan pKw
- Derajat Ionisasi dan Hubungannya dengan Ka dan Kb
- Menghitung pH Larutan Asam
- Menghitung pH Larutan Basa
- Cara Kerja Indikator Kertas Lakmus Dalam Membedakan Senyawa Asam dan Basa
- Reaksi Penetralan
- Reaksi - Reaksi Asam Basa
- Asam - Asam Paling Berbahaya Di Dunia
- Perbedaan Asam dan Basa Kuat Dengan Asam Dan Basa Lemah
- Daftar Lengkap Senyawa Asam Kuat, Basa Kuat, Asam Lemah, Basa Lemah Beserta Reaksi Ionisasinya
- Menghitung pH Campuran Dua Larutan Asam Atau Dua Larutan Basa
- Menentukan pH Campuran Larutan Asam Kuat dan Basa Kuat
- Menentukan Warna Indikator Dalam Larutan Dengan pH Tertentu
- Menentukan Massa Zat Yang Harus Dilarutkan Untuk Membentuk Larutan Asam atau Basa Dengan pH Tertentu
- Urutan Kekuatan Asam dan Basa Berdasarkan pH dan Ka atau Kb






Posting Komentar untuk "Teori Asam Basa Lewis"