Jelaskan Perbedaan Antara Sel Galvani/Volta dengan Sel Elektrolisis!
Artikel ini menjelaskan tentang perbedaan antara sel Galvani atau sel volta dengan sel elektrolisis dari berbagai aspek.
Berikut ini adalah perbedaan antara sel Galvani atau sel volta dengan sel elektrolisis.
Fungsi Sel
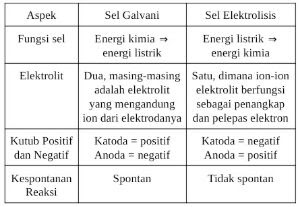
Sel Galvani atau sel Volta merupakan rangkaian sel yang bertujuan untuk mengubah energi kimia menjadi energi listrik.
Sedangkan sel elektrolisis adalah rangkaian sel yang digunakan untuk menciptakan reaksi kimia menggunakan energi listrik.
Elektrolit
Pada sel Galvani, elektroda dicelupkan pada larutan elektrolit yang mengandung ion dari elektroda tersebut.
Misalnya, elektroda yang digunakan adalah Zn dan Cu. Maka, Zn dicelupkan pada larutan elektrolit ZnSO4 dan Cu pada larutan elektrolit CuSO4.
Jadi ada dua jenis elektrolit yang berbeda yang ditempatkan pada wadah yang berbeda pula.
Sedangkan pada sel elektrolisis, elektrolit yang digunakan hanya satu jenis dan kedua elektroda selnya dicelupkan pada elektrolit tersebut.
Fungsi dari elektrolit pada sel elektrolisis adalah untuk menyediakan partikel yang dapat menangkap dan melepaskan elektron.
Kutub Positif dan Negatif
Pada kedua sel, sama-sama berlangsung reaksi reduksi dan oksidasi. Reduksi selalu berlangsung di katoda dan oksidasi selalu di anoda, apapun jenis sel elektrokimianya.
Perbedaan terletak pada kutub positif dan negatif dari kedua sel.
Kutub Positif dan Negatif Pada Sel Galvani
Pada sel Galvani, yang mengubah energi kimia menjadi energi listrik, reaksi bermula dari oksidasi terjadi di anoda.
Karena dari reaksi oksidasi, dibebaskan elektron yang dapat mengalir di dalam kawat, sebelum akhirnya bergerak menuju katoda.
Berarti, yang menjadi sumber elektron pada sel Galvani adalah elektroda tempat reaksi oksidasi berlangsung yaitu di anoda.
Karena bertindak sebagai sumber elektron, maka anoda pada sel Galvani merupakan kutub negatif dan katoda tempat berlangsung reaksi reduksi adalah kutub positifnya.
Jadi kesimpulannya, pada sel Galvani:
Katoda = positif
Anoda = negatif
Untuk memudahkan kita mengingat kutub pada sel Galvani, dibuat akronim KPAN (baca kapan yang artinya katoda positif dan anoda negatif).
Kutub Positif dan Negatif Pada Sel Elektrolisis
Karena sel elektrolisis menggunakan energi listrik untuk menciptakan reaksi kimia, maka reaksi bermula di katoda tempat reaksi reduksi berlangsung.
Elektron akan ditangkap oleh ion positif elektrolit disekitar katoda sehingga mengalami reduksi.
Karena elektron mengalir dari katoda (ion positif), maka pada sel elektrolisis, katoda menjadi kutub negatif
Di saat yang bersamaan, ion negatif elektrolit akan mengalami oksidasi sehingga menghasilkan elektron yang kemudian mengalir ke anoda.
Oleh sebab itu, anoda menjadi kutub positif.
Jadi, kesimpulannya, pada sel elektrolisis:
Katoda = kutub negatif
Anoda = kutub positif
Akronim atau singkatan untuk mempermudah kita mengingat kutub pada sel elektrolisis ini adalah KNAPE (yang artinya katoda negatif dan anoda positif).
Saat membuat rangkaian sel Galvani maupun elektrolisis, kita tidak boleh memasang kutub secara terbalik. Kalau terbalik, listrik tidak akan mengalir.
Jenis Reaksi (Spontan atau Tidak)
Reaksi yang terjadi pada sel Galvani adalah reaksi spontan. Dengan sendirinya, karena perbedaan potensial reduksi masing-masing elektroda, elektron mengalir dari elektroda yang potensial reduksinya lebih kecil ke elektroda yang potensial reduksinya lebih besar.
Sedangkan pada sel elektrolisis, reaksi yang terjadi adalah tidak spontan. Jika tidak diberi aliran listrik, maka reaksi ion-ion disekitar elektroda tidak akan berjalan.
Kesimpulan:
Dari penjelasan diatas, kita bisa mengambil kesimpulan tentang perbedaan antara sel Galvani dan Elektrolisis yang disajikan dalam tabel berikut.
Sekian penjelasan tentang perbedaan sel Galvani dan Elektrolisis. Semoga bermanfaat.
Posting Komentar untuk "Jelaskan Perbedaan Antara Sel Galvani/Volta dengan Sel Elektrolisis!"