Bagaimana Cara Menyetarakan Reaksi Redoks Dengan Metode Setengah Reaksi dan Bilangan Oksidasi?
Artikel ini menjelaskan tentang cara menyetarakan reaksi redoks menggunakan metode setengah reaksi dan bilangan oksidasi melalui contoh soal dan pembahasannya.
Contoh Soal
Setarakanlah reaksi berikut dengan metode setengah reaksi dan bilangan oksidasi
- Cu + NO3- + H+ ⇒ Cu2+ + NO + H2O
- Cr2O7^2- + H+ + Cl- ⇒ Cr^3+ + H2O + Cl2
- Cr2O7^2- + AsO3^3- ⇒ Cr^3+ + AsO4^3-
- MnO4^- + H+ + H2C2O4 ⇒ Mn^2+ + H2O + CO2
- Fe^2+ + Cr2O7^2- ⇒ Fe^3+ + Cr^3+
- P + NO3^- ⇒ PO4^3- + NO
Pembahasan:
Menyetarakan reduksi redoks itu susah-susah gampang.
Oleh karena itu, agar kamu memahami cara menyetarakan reaksi redoks baik dengan metode setengah reaksi atau cara bilangan oksidasi, perhatikan langkah-langkah penyetaraan dibawah ini.
Penyetaraan reaksi 1: Cu + NO3- + H+ ⇒ Cu2+ + NO + H2O
Pada reaksi diatas, ada ion H+ dibagian kiri. Adanya ion H+ ini memberikan informasi kepada kita kalau penyetaraan reaksi ini adalah dalam suasana asam.
Jika tidak diketahui penyetaraan dalam suasana apa, kerjakan dengan cara asam.
Metode Setengah Reaksi
Cu + NO3- + H+ ⇒ Cu2+ + NO + H2O
Singkirkan terlebih dahulu H+ dan H2O dari reaksi diatas karena spesi itu akan ditambahkan pada proses penyetaraan reaksi.
Cu + NO3- ⇒ Cu2+ + NO
Langkah pertama dalam penyetaraan reaksi menggunakan metode setengah reaksi adalah membuat setengah reaksi reduksi dan oksidasi.
Jika kalian tidak tahu mana yang reduksi dan oksidasi, tidak perlu khawatir. Buat saja reaksi perubahan dari masing-masing spesi.
Cu ⇒ Cu2+
NO3- ⇒ NO
Langkah kedua, setarakan jumlah atom yang mengalami perubahan bilangan oksidasi.
Pada setengah reaksi diatas, baik jumlah Cu dan N sudah setara. Jadi, langkah ini tidak perlu lagi dilakukan.
Langkah ketiga adalah menyetarakan jumlah atom oksigen.
Pada reaksi perubahan Cu menjadi Cu^2+, tidak ada atom O yang terlibat. Jadi, biarkan saja reaksi ini.
Yang perlu kita setarakan adalah setengah reaksi kedua yaitu:
NO3^- ⇒ NO
Menyetarakan oksigen pada suasana asam dilakukan dengan menambah H2O dengan jumlah yang bersesuain disisi yang kekurangan oksigen.
NO3^- ⇒ NO + 2H2O
Jadi, sampai disini kita punya reaksi:
Cu ⇒ Cu2+
NO3- ⇒ NO + 2H2O
Langkah keempat adalah menyetarakan jumlah atom H. Pada setengah reaksi pertama, juga tidak ada hidrogen yang terlibat. Jadi, biarkan kembali reaksinya seperti itu.
Pada setengah reaksi kedua, ada H yang terlibat. Samakan jumlah H dengan cara menambah H+ di sisi yang kekurangan H.
Cu ⇒ Cu2+
NO3- + 4H+ ⇒ NO + 2H2O
Langkah kelima, setarakan jumlah muatan. Karena reaksi diatas melibatkan ion-ion, maka muatan kiri dan kanan pasti tidak sama.
Misalnya pada setengah reaksi pertama. Dikiri muatannya nol dan dikanan +2. Agar muatan setara, tambahkan 2e (e = muatan negatif) dibagian yang kelebihan muatan.
Cu ⇒ Cu^2+ + 2e
Pada setengah reaksi kedua, muatan dikiri adalah -1 + 4 = +3 dan dikanan adalah nol. Tambahkan tiga elektron dibagian kiri atau pada sisi yang kelebihan muatan.
NO3- + 4H+ + 3e ⇒ NO + 2H2O
Reaksi yang kita punya sekarang adalah:
Cu ⇒ Cu^2+ + 2e
NO3- + 4H+ + 3e ⇒ NO + 2H2O
Sebelum reaksi diatas dijumlahkan, setarakan dahulu jumlah elektron dikedua reaksi.
NO3- + 4H+ + 3e ⇒ NO + 2H2O x 2
2NO^3- + 8H+ + 6e ⇒ 2NO + 4H2O +
Setelah jumlah elektron dikedua reaksi sama, baru reaksi dapat kita jumlahkan. Hasilnya adalah:
3Cu + 2NO3^- + 8H+ ⇒ 3Cu^2+ + 2NO + 4H2O
Reaksi diatas sudah setara.
Sampai disini, kita berhasil menyetarakan reaksi redoks menggunakan metode setengah reaksi.
Bagaimana dengan metode bilangan oksidasi? Apa cara pengerjaannya lebih mudah atau lebih susah dari metode setengah reaksi? Mari simak penjelasan berikut.
Metode Bilangan Oksidasi
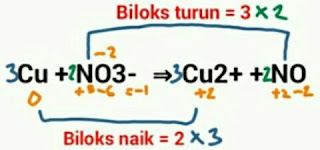
Cu + NO3- ⇒ Cu2+ + NO
Karena menggunakan metode bilangan oksidasi, maka langkah pertama yang akan kita lakukan adalah menentukan bilangan oksidasi unsur sekaligus mencari berapa besar penurunan dan kenaikan biloks.
Langkah kedua ada mengali silang angka perubahan biloks dengan koefisien unsur-unsur dalam reaksi.
Hasil reaksi setelah langkah kedua adalah:
3Cu + 2NO3^- ⇒ 3Cu^2+ + 2NO
Langkah ketika adalah menyetarakan jumlah oksigen. Karena reaksi dalam suasana asam, maka menyetarakan jumlah oksigen dilakukan cara menambahkan H2O pada sisi yang kekurangan oksigen.
3Cu + 2NO3^- ⇒ 3Cu^2+ + 2NO + 4H2O
Langkah keempat adalah menyetarakan jumlah H dengan menambah H+ di sisi yang kekurangan H.
3Cu + 2NO3^- + 8H+ ⇒ 3Cu^2+ + 2NO + 4H2O
Langkah terakhir, cek jumlah muatan kiri dan kanan, apakah sudah sama. Jika cara kamu dalam menyetarakan reaksi benar, maka jumlah muatan langsung setara, seperti pada reaksi diatas.
Sampai disini, kamu sudah berhasil menyetarakan reaksi dengan metode bilangan oksidasi.
Cara mana yang lebih mudah? Pilihan itu bergantung padamu.
Penyetaraan untuk reaksi 2 dan 3 dapat lihat dengan mengunjungi tautan berikut: dan penyetaraan reaksi 4, 5 dan 6 dapat kamu lihat disini:
Sekian penjelasan tentang cara menyetarakan reaksi redoks menggunakan metode setengah reaksi dan bilangan oksidasi. Semoga bermanfaat.

Posting Komentar untuk "Bagaimana Cara Menyetarakan Reaksi Redoks Dengan Metode Setengah Reaksi dan Bilangan Oksidasi?"