Daftar Bentuk Molekul Berbagai Macam senyawa dengan Teori Domain Elektron/VSEPR
Di dalam artikel ini kita akan membahas mengenai cara menentukan bentuk molekul senyawa, jika yang diketahui hanya nomor atom unsur-unsur pembentuknya, menggunakan teori domain elektron atau VSEPR (valence shell electron pair repulsion).
Bentuk Molekul Berbagai Macam Senyawa
Bentuk Molekul BeCl2
Diketahui, nomor atom Be = 4 dan Cl = 17
Langkah-langkah untuk menentukan bentuk molekul senyawa:
Langkah pertama = membuat konfigurasi elektron untuk mencari tahu berapa banyak elektron valensi yang dimiliki. Elektron valensi ini nantinya akan digunakan Bersama untuk mebentuk ikatan kovalen pada dua unsur.
Konfigursi elektron:
Be = 2 2 = jumlah elektron valensi = 2
Cl = 2 8 7 – jumlah elektron valensi = 7
Langkah kedua adalah, menentukan mana yang atom pusat dan mana yang atom cabang. Atom pusat biasanya adalah atom logam atau yang jumlahnya paling sedikit. Sedangkan, atom cabang adalah atom non logam yang jumlahnya paling banyak.
Pada BeCl2, Be = atom pusat dan Cl = atom cabang.
Langkah ketiga adalah membuat struktur lewis dari BeCl2. Kamu sudah mengetahui bahwa tujuan unsur-unsur saling berikatan adalah untuk mencapai kestabilan seperti unsur gas mulia yang punya 8 elektron valensi (kaidah oktet). Atom Cl mempunyai 7 elektron valensi. Agar stabil seperti unsur gas mulai, Cl hanya butuh satu elektron lagi. Itu artinya, Cl hanya akan membentuk ikatan tunggal dengan Be (memakai satu pasang elektron secara bersama-sama).
Catatan:
Jika atom cabangnya adalah H dan unsur-unsur halogen (F, Cl, Br, I), makai katan yang akan dibentuknya dengan atom pusat adalah ikatan tunggal. Hal ini disebabkan karena unsur-unsur ini hanya butuh satu elektron lagi agar stabil.
Struktur lewis dari BeCl2 adalah:
Pada teori domain elektron, terdapat hubungan antara rumus dengan bentuk molekul senyawa. Rumus untuk menentukan bentuk molekul senyawa dengan teori domain elektron/VSEPR adalah:
Berikut adalah tabel yang menunjukkan hubungan antara rumus diatas dengan bentuk molekul senyawa.
Jumlah X atau pasangan elektron ikatan = jumlah atom cabang yang berikatan dengan atom pusat (baik ikatan tunggal, rangkap dua atau rangkap tiga pada teori domain elektron tetap dihitung satu domain). Jumlah pasangan elektron ikatan pada BeCl2 adalah 2.
Jumlah E = jumlah pasangan elektron bebas yang dimiliki oleh atom pusat. Sebelumnya, Be hanya punya 2 elektron valensi dan keduanya digunakan untuk berikatan dengan Cl (lihat struktur lewis BeCl2 diatas), sehingga Be tidak punya pasangan elektron bebas atau E = 0
Oleh karena itu, rumus/notasi VSEPR dari BeCl2 adalah AX2. Jika kita lihat tabel diatas, bentuk molekul dengan notasi AX2 adalah linier. Nah, sampai disini kalian sudah bisa menentukan bentuk molekul suatu senyawa berdasarkan teori domain elektron/VSEPR.
Cara diatas cukup panjang karena saya pikir perlu menjelaskan secara detail bagaimana langkah-langkah dalam menentukan bentuk molekul suatu senyawa. Untuk senyawa lain, pengerjaannya akan saya singkat aja biar lebih efisien.
Bentuk molekul BCl3 dan BF3
Diketahui, nomor atom B = 5, Cl = 17 dan F = 9.
Pada kedua senyawa diatas, kita mengetahui bahwa B adalah atom pusatnya dan Cl serta F adalah atom cabang. Karena konfigurasi elektron B = 2 3, maka jumlah elektron valensinya = 3.
Pada penjelasan sebelumnya sudah saya kasih tahu bawah X = pasangan elektron ikatan = jumlah subtituen (atom cabang ) yang melekat pada atom pusat. Pada senyawa BCl3 dan BF3, jumlah PEI = X = 3.
Ingat, jika unsur halogen adalah cabangnya (Cl dan F ), maka ikatan yang dibentuk dengan atom pusat selalu tunggal. Itu artinya, untuk berikatan dengan tiga buah Cl atau F, unsur B perlu menyumbangkan tiga elektron valensinya untuk dipakai bersama-sama mebentuk ikatan kovalen.
Sebelumnya, kita udah tahu nih kalau elektron valensi atom B hanya ada tiga, dan ketigannya digunakan untuk berikatan dengan Cl dan F sehingga atom pusat B tidak memiliki pasangan elektron bebas (E = 0).
Maka dari itu, notasi VSEPR untuk BCl3 dan BF3 adalah sama yaitu AX3 dengan bentuk molekul keduanya adalah segitiga planar. Nah, mudah bukan.
Bentuk molekul CH4 dan CCl4 (nomor atom C = 6, nomor atom H = 1 dan nomor atom Cl = 17)
Konfigurasi elektron
C = 2 4 = elektron valensi = 4
H = 1 = elektron valensi
Cl = 2 8 7 = jumlah elektron valensi
Pada CCl4 dan CH4, C adalah atom pusat dan H dan Cl adalah atom cabang. Sapa seperti molekul sebelumnya, H dan Cl akan berikatan tunggal dengan C. Itu artinya jumlah pasangan elektron bebas = X pada kedua senyawa adalah 4.
Atom C punya 4 elektron valensi, dan keempatnya sudah digunakan untuk berikatan tungga dengan 4 atom H pada CH4 dan 4 atom Cl pada CCl4. Itu artinya, semua elektron valensi C sudah digunakan semua untuk berikatan sehingga jumlah pasangan elektron bebas = E = 0.
Notasi elektron untuk CCl4 dan CH4 adalah AX4 sehingga kedua molekul tersebut memiliki bentuk tetrahedral.
Bentuk molekul NH3 (nomor atom N = 7 dan H = 1)
Kali ini, saya akan singak lagi caranya agar lebih efisien. Elektron valensi atom pusat N = 5 dan H = 1. Karena ada 3 atom H yang berikatan tunggal dengan N, maka ada 3 pasangan elektron ikatan disekitar atom N. Untuk membentuk tiga ikatan tunggal tersebut, N menyumbangkan 3 elektron valensi miliknya. Artinya ada dua elektron lagi yang tidak digunakan berikatan. Dua elektron ini adalah sepasang elektron bebas.
NH3 memiliki notasi VSEPR = AX3E. Sesuai dengan tabel diawal, bentuk molekul dari NH3 adalah piramida segitiga/trigonal piramida.
Bentuk Molekul H2O
O atom pusat punya 6 elektron valensi (konfigurasi = 2 6). Dengan H, O akan berikatan tungga sehingga menyumbangkan 2 buah elektron valensinya. Itu artinya, sisa 4 elektron yang tidak digunakan untuk berikatan yang berupa dua pasang elektron bebas. Notasi VSEPR H2O = AX2E2 dengan bentuk molekul bengkok/bentuk V.
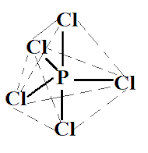
Bentuk molekul PCl5
Konfigurasi elektron P = 2 8 5, dengan 5 elektron valensi. Cl sebagai unsur halogen hanya membentuk ikatan tunggal dengan P, sehingga P menyumbangkan seluruh elektron valensi yang dimilikinya untuk berikatan dengan 5 Cl. Jumlah pasangan elektron ikatan = 5 dan jumlah pasangan elektron bebas = 0. Notasi VSEPR = AX5 dengan bentuk molekul bipiramida trigonal.
Bentuk molekul TeCl4
Te adalah unsur golongan VIA sehingga punya 4 elektron valensi (kalian bisa tentukan jumlah elektron valensi dengan konfigurasi elektron, tapi saya malas karna nomor atom Te cukup besar).
Te sebagai atom pusat berikatan tunggal dengan 4 buah Cl sehingga jumlah pasangan elektron ikatannya adalah 4. Tersisa dua buah elektron valensi sebagai satu pasang elektron bebas yang tidak digunakan untuk berikatan. Notasi VSEPR = AX4E = tetrahedral terdistorsi/bentuk timbangan.
Bentuk molekul ClF3
Pada molekul ClF3, kali ini Cl yang merupakan atom pusat dan F adalah atom cabang. Kita tahu, Cl dan F sama-sma memiliki 7 elektron valensi. Untuk berikatan tunggal dengan tiga buah atom F, atom Cl telah menyumbangkan 3 buah elektonnya. Itu artinya, masih tersisa 4 elektron yang tidak digunakan berikatan sebagai 2 pasang elektron bebas. Notasi VSEPPR = AX3E2 = bentuk T.
Bentuk molekul XeF2
Xe adalah unsur gas mulai dengan 8 elektron valensi dan berikatan tunggal dengan dua F. Itu artinya dua bah elektron Xe telah digunakan untuk berikatan dengan F membentuk molekul XeF2. Pada atom Xe, ada 6 elektron yang tidak digunakan untuk berikatan sehingga notasi VSEPR dari molekul ini adalah AX2E3 dengan entuk molekul linier.
Bentuk Molekul SeF6
Se adalah unsur golongan VIA dengan 6 elektron valensi. Se berikatan tunggal denga 6 F membentuk molekul SeF6 sehingga ada 6 pasangan elektron ikatannya. Semua elektron valensi Se sdah digunakan untuk berikatan sehingga SeF6 tidak punya pasangan elektron bebas. Notasi VSEPR = AX6 dengan bentuk molekul tetrahderal.
Bentuk Molekul IF5
I dan F sama-sama unsur halogen dengan 7 elektron valensi. Jumlah ikatan tunggal yang terbentuk pada senyawa IF5 adalah 5 sehingga pasangan elektron bebas = X = 5. Ada satu pasang elektron yang bertindak sebagai pasangan elektron bebas pada atom pusat I sehingga notasi VSEPR untuk IF5 adalah AX5E dengan bentuk molekul piramida segiempat.
Bentuk Molekul XeF4
Jumlah elektron valensi Xe = 8 ( golongan VIIIA) dan berikatan tunggal dengan 4 buah F. Itu artinya, selain terdapat 4 buah pasangan elektron ikatan, ada juga dua pasangan elektron bebas pada atom Xe yang tidak digunakan untuk berikatan. Notasi VSEPR XeF4 = AX4E2 dengan bentuk molekul segiempat planar/segiempat datar.
Kalau semua senyawa diatas, atom cabangnya kan berikatan tunggal dengan atom pusat. Bagaimana jika ada atom cabang yang bisa membentuk ikatan rangkap dua atau bahkan ikatan rangkap tiga dengan atom pusatnya? Bagaimana cara menentukan bentuk molekulnya.
Bentuk Molekul SO3
Contoh: SO3 (nomor atom S = 16 dan O =8).
Pada senyawa SO3, S sebagai atom pusat mengikat tiga buah O, yang artinya terdapat 3 pasangan elektron ikatan dalam senyawa (PEI).
Baik atom S maupun O sama-sama memiliki 6 elektron valensi. O akan stabil jika menerima dua elektron lagi. Itu artinya, O membentuk ikatan rangkap dua dengan S. Karena ada tiga buah O yang berikatan dengan S, maka atom S akan menggunakan seluruh elektron valensinya untuk berikatan. Itu artinya, tidak ada pasangan elektron bebas pada atom pusat.
Notasi VSEPR untuk SO3 adalah AX3 dengan bentuk molekul segitiga datar.
Nah, itulah pembahasan kita kali ini secara lengkap tentang bentuk mloekul berbagai macam senyawa menggunakan teori domain elektron/VSEPR. Semoga kalian dapat memahami penjelasan diatas. Terimakasih sudah berkunjung ke blog ini.
- Contoh Soal Gaya Antar Molekul dan Pembahasannya
- Materi Gaya Antar Molekul
- Materi Kestabilan Unsur
- Materi Aturan Oktet dan Penyimpangannya
- Contoh Soal Teori Hibridisasi
- Contoh Soal Bentuk Geometri Molekul dengan Teori Domain elektron
- Materi Bentuk molekul dengan teori domain elektron
- Contoh soal Bab Ikatan Kimia Ikatan Kovalen dan Senyawa Kovalen
- Jenis-Jenis Ikatan Kovalen
- Perbedaan Ikatan Ion dan Kovalen Dari Proses Pembentukannya
- Contoh soal bab Ikatan kimia kestabilan unsur dan struktur lewis
- Perbedaan ikatan kovalen polar dan non polar
- Contoh soal tentang struktur lewis
- Struktur Lewis senyawa ion
- Struktur Lewis senyawa kovalen














Posting Komentar untuk "Daftar Bentuk Molekul Berbagai Macam senyawa dengan Teori Domain Elektron/VSEPR"